|
세계 바이오의약산업 2011
(주)K2B대표
경제학박사 김태억
[ 목 차 ]
1. 총론
2. 파머징국가의 성장
3. 연구개발생산성의 위기
4. 항체신약의 새로운 흐름
5. 분자진단과 맞춤형 치료
6. 비즈니스모델 변화와 지식서비스시장의 성장
요 약
○ 본 보고서는 2007년부터 본격화되기 시작한 세계 바이오의약산업의 연구개발 생산성 위기와 특허만료로 인한 시장성장율의 저하가 가져오고 있는 바이오의약산업의 구조적 변화를 서너가지 이슈를 통해 다루어 보았다.
○ 최근 글로벌 제약기업들을 중심으로 급격하게 늘어난 M&A와 라이센싱 인, 그리고 파머징국가의 바이오기업은 물론이고 머크사 화이저 등 글로벌 기업들까지 바이오시밀러 시장에 진입하는 현상들은 구조적 변화에 대한 단기적 대응방안임에 반해 개방형 기술혁신과 와해성 원천기술의 사업화를 위한 지식서비스 역량의 강화에 기반한 차세대 바이오의약품으로의 전략적 진입은 보다 중장기적 대응이라고 할 수 있다.
○ 본 보고서는 세계 바이오의약시장의 구조적 변화양상을 분석한 뒤, 새로운 성장동력으로 떠오르고 있는 파머징 국가들의 시장상황을 간단하게 살펴본 후 최근 본격화되고 있는 연구개발 생산성 위기의 원인진단 및 대안에 대해 분석했다. 다음으로 차세대 항체신약 기술개발동향을 살펴봄으로써 바이오시밀러 이후 혹은 바이오베터를 준비하는 기업들이 직면하게 될 2011-2012년 항체시장을 예측해 보았으며, 분자진단 기술에 기반한 맞춤형의약의 가능성을 진단해 보았다.
○ 마지막으로 현재 진행되고 있는 바이의약산업의 구조적 변화를 선도하고, 향후 비즈니스 경쟁력의 핵심적 구성요소가 될 지식서비스 분야의 성장전망과 주요과제들에 대해 살펴보았다. 특히 지식서비스 분야는 우리나라와 같이 자본규모와 국내 시장규모가 작은 나라의 기업들이 글로벌 기업들과의 경쟁에서 살아남기 위해서는 가장 집중적인 투자가 이루어져야 할 분야이지만, 정부나 기업 모두가 간과하고 있는 영역이다.
○ 2010년이 바이오시밀러의 해라고 정의한다면, 2011년은 바이오시밀러 이후의 전략적 결단을 요구하는 해라고 말할 수 있다. 바이오의약품 출시를 위해서는 약 10여년, 최근의 기술진보를 고려한다 해도 최소 약 8년 이상의 기간이 필요하다. 따라서 구조변화가 가져올 새로운 시장트렌드에 뒤쳐지지 않으려면 최소 향후 5년 이후의 대안을 탐색, 전략적 선택을 해야 할 시점이다. 이와 관련 항체신약은 이미 2004-2006년을 정점으로 성장기에서 성숙기로 접어들었으며 글로벌 기업들 역시 백신치료제, RNAi, 세포치료제 등 차세대 분야에 대한 전략적 투자를 강화하고 있다. 차세대 분야의 경우 2010년 현재 시장출시된 제품들이 1-3개 내외이지만 향후 5년 이내 최소 40개 이상의 제품 출시가 가능할 것이다. 그 중에서도 특히 백신치료제는 항체신약이 가진 면역거부반응이나 약효 등의 측면에서 기술적으로 우월한 대안으로 평가되고 있으며, RNAi나 세포치료제의 경우 항체신약이 치료하기 어려운 중증난치성 질환에 대한 신개념 치료의 가능성을 제시하고 있기에 더욱 중요하게 다루어져야 할 주제이다. 하지만 이러한 주제들을 모두 담아내기에는 여러 제약사항들이 존재하기에 2011년 초반에 별도의 보고서를 통해 다루기로 하고 여기에서는 본문의 이곳저곳에서 간략하게 언급하는 정도로 그칠 수밖에 없었다.
○ 본 보고서는 DataMonitor, Frost&Surlivan, Market Research, Business Insight, Business Monitor, BCC Research 등 전문컨설팅 기관이 제공하는 각종 보고서 100여개 이상을 모두 검토한 후 우리나라의 관점에서 제기될 수 있는 중요이슈들을 중심으로 재구성한 결과이다. 또한 이 과정에서 추가적인 연구조사가 필요한 내용들은 Nature Publisher에서 발간하고 있는 50여개 연구저널이나 혹은 최근에 발간된 100여권 이상의 단행본을 참조하는 방식으로 작성되었다. 이러한 이유로 본 보고서에서는 꼭 필요하다고 판단되는 경우가 아니면 수치나 논거의 출처를 명기하지 않았다. 보다 자세한 분석과 출처 및 근거가 필요한 분들은 저자에게 직접 연락하여 도움을 얻을 수 있다. goodk2b@gmail.com
1. 총론
세계의약시장 메가트렌드
○ 바이오 의료기술의 성장과 경제적 조건의 진보에 따라 전세계적으로 노령화 현상이 급속하게 진행되고 있으며, 주요 선진국의 고령화 비율은 대략 약 25% 수준을 넘고 있다. 이에 따라 고령인구에서 주로 나타나는 난치성 중대질환의 비중이 크게 증가하고 있으며, 심혈관 질환, 암 및 종양, 류마티스, 알츠하이머 등 CNS 계열의 치료제 개발, 줄기세포를 활용한 치료기술 개발에 투자가 집중되고 있다.
○ 전세계 의료시장은 09년 현재 5.5-6조 달러이며, 미국에서만 2.5조 달러로 추정되고 있다. 특히 2005년부터 2040년까지 65세 고령인구는 전세계적으로 약 171%의 성장을 할 것으로 예상되며 2020년을 전후하여 그 속도가 완만해질 것으로 예상된다. 그와 동시에 전세계적 인구는 40년까지 36% 정도 성장할 것으로 예상되어 2040년 87억명으로 추정된다. 세계 의약시장의 40%를 차지하는 미국은 인구 중 17%가 연금세대에 해당하는 등 앞으로도 지속적으로 사회적 의료비 부담이 크게 작용할 것으로 예상된다. (미국 의약품시장 중 677억 달러가 일반의약, 183억 달러가 OTC, 2313억 달러가 특허의약)
의약품 시장 년차별 시장규모
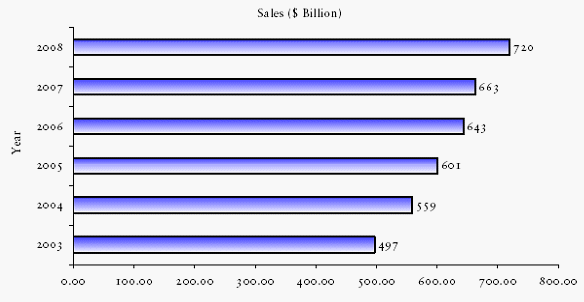
○ 의료산업의 세계시장 규모는 2006년 643조원에서 2011년 853조로 5년간 35%이상의 고성장세를 지속하고 있으며, 전세계적으로 각국의 의료비 지출은 2004년 41,170억 달러에서 2014년 82,480로 2배 이상 증가하여 년평균 성장 8.82%의 증가율을 보이고 있다. 특히 동유럽과 남미 등의 국가에서는 년평균 10% 이상의 고성장이 예상되는 등 새롭게 떠오르는 파머징 국가들로부터의 의료수요가 전세계 시장을 이끌어 갈 것으로 예상되고 있다. 하지만 미국은 단일시장으로 총 35,236억 달러의 시장규모를 확보, 다른 국가들에 비해 평균 10배 이상, 전세계 시장의 40% 이상을 점유하는 등 앞으로도 오래동안 세계 의약시장에서 지배적인 역할을 할 것으로 예상된다.
○ 미국의 경우 미국인 중 37백만명이 질병에 걸려 있으며 이중에서 감염성 질환은 5.13%이고 나머지는 일반질환으로 의약을 통한 치료가 일반적이다. 감염성 질환은 2009년 52만명에서 2030년 85만명 수준으로 증가할 것으로 예상되며, 비감염성 질환의 경우는 31백만명으로 신경정신과질환이 37.43%, 심혈관 질환이 15.72%, neoplasm이 14.28%, 당뇨질환이 6.33%로 구성되어 있다.
○ 미국의 전체 의료비용은 GDP의 13% 수준에 도달하여 GDP 성장률보다 빠른 속도로 증가하고 있는 등 사회적 의료비용 부담이 가장 중요한 국가적 이슈중의 하나가 되고 있다. 2010년 통과된 오바마 의료개혁법안은 이러한 문제를 해결하기 위한 방안 중의 하나로서 보편적 의료보험의 확대, 바이오시밀러 도입 등을 통한 바이오의약산업 내에서의 가격경쟁 활성화, 세금면제-자금지원 등을 통한 연구개발 촉진으로 기술혁신 경쟁 강화, FDA의 기능전문화와 확대, 그리고 약효경제성 평가 시스템 도입 등을 통해 의약개발 및 생산에 있어서 사회적 비용합리성을 달성하기 위한 것으로 파악된다.
○ 전세계 의약품 시장은 통계소스에 따라 약간 다르지만 6,000~8,000억 달러 내외에서 변동하고 있으며, 시장성장률은 5.5% 내외 수준으로 전년도와 비슷한 수준을 유지하고 있다. 이러한 시장성장율은 상당부분 파머징 국가군의 높은 성장률에 기인하는 것으로, 특히 미국이나 유럽의 경우는 1~2%, 3~4%가 성장하는데 반해 일본은 4~5%, 파머징은 14~15% 성장한 것으로 나타났다. 그중에서 미국은 3,000억 달러, 유럽은 1,280억 달러, 일본은 840억 달러, 파머징 7개국은 1,150억 달러로 추정. 바이오의약품은 세계시장 1,080억 달러이며 중국이나 인도, 러시아를 비롯한 파머징 국가의 총 시장 규모는 각각 224억, 84억 달러로, 전세계 의약시장에서의 점유율 상승과 함께 파머징 국가군에서도 높은 성장세를 보여주고 있다.
전세계 의약시장 국가별 점유율

각국별 의약시장 년도별 성장 현황 (Frost&Surlivan, 2009)
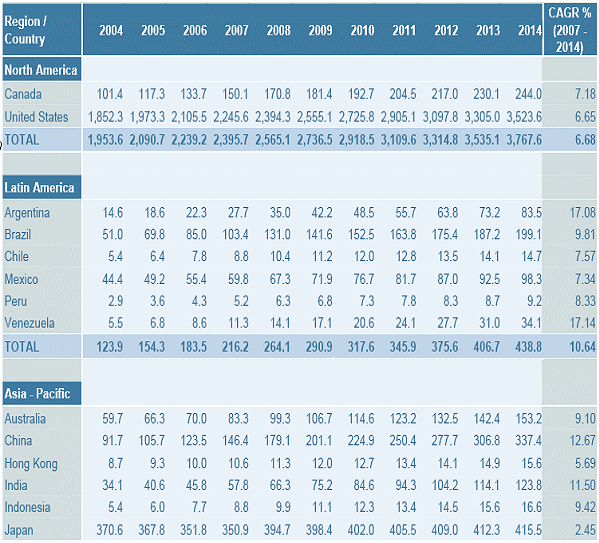
○ 2009년 세계 의약품 시장의 총규모는 8,200억 달러로 전년 대비 4.8~5.5%가 증가했는데, 이 중에서 합성의약은 3.7% 성장한 반면에 바이오의약품은 전체평균 17%, 백신제품의 성장률은 19%, 항체의약품은 15%로 바이오의약품의 성장률이 압도적으로 높게 나타났다. 그 결과 전체 의약품 매출액 중 바이오의약품이 차지하는 비율은 2002년 9%에서 2007년 17%, 10년에는 25% 이상을 차지할 것으로 예상되고 있다. 특히 바이오의약품의 경우 일반의약품은 성장률이 2~3%인 반면에 전문의 처방약품은 8% 성장률을 나타내서 시장접근에 있어서 병원중심의 전문의가 매우 중요한 역할을 하는 것으로 나타났다.
○ 주요 선진국을 중심으로 국민총생산에서 의료비 지출이 차지하는 비율이 점점 높아지고 있으며 이에 따라 2010년 해외의료서비스에 대한 의료수요는 약 1,000억 달러, 총 1,000만명으로 확대될 것으로 예상되고 있다. 특히 미국의 경우 높은 의료비용으로 인해 의료보험에 가입되지 않은 4,500만명 중 약 150만명 정도가 매년 해외의료서비스를 이용할 것으로 예상되어 세계에서 가장 큰 해외의료 수요시장을 형성하고 있다.
○ 해외 의료서비스 시장은 초기에는 의료관광의 형태로 출발했으나 최근에는 의료비용/서비스품질을 기준으로 질환치료에 보다 집중되고 있다. 이는 저개발국의 휴양관광지를 중심으로 형성된 해외의료시장이 선진국을 중심으로 변화하는 것에서도 드러나며, 미용이나 성형 중심에서 줄기세포를 활용한 난치성 질환 치료분야에서 가장 높은 수익률과 성장률을 보이고 있다. (미국이 가장 많은 의료관광 수요를 갖고 있는 동시에 전세계 고소득 환자들이 가장 많이 의료서비스를 받기 위해 방문하는 국가이기도 하다). 해외의료 서비스 제공국가로는 인도, 싱가폴, 말레이시아, 멕시코, 코스타리카, 헝가리, 브라질, 걸프연안국, 남아프리카, 태국 등인데 이들의 의료서비스 가격은 미국의 20-50% 수준이며 2010년경 6백만명의 환자들이 국외 의료서비스를 구매할 것으로 예상된다.
OECD, 2009
|
시장상황 |
기술적과제 |
전략적 고려 |
비고 |
|
바이오
시밀러 |
-‘15년 50억달러
- 경쟁포화 시장으로
선진기업에 비해
3 - 4 년 격차
- 높은 진입장벽
- 바이오베터에주력할
필요 |
- 생물학적 동등성
확보
- 50%이상 각격경
쟁력 확보
- 슈퍼시밀러 중심
의 Open R&D |
- 개방형 비즈니스를
통한 비용절감
- 조기에 시장선점
하는 것이 필수
- 개도국 시장접근 |
|
|
항체 |
- ’10년 400억 (34%)
시장집중도 86%
- 2 세대 중심으로 경쟁 |
- 항체신약의 난점
을 해결할 솔루션
탐색
- 인디케이션 다분
분화와 최적화
엔지니어링 |
- 5년후 차세대분야
로 진입 준비
- 스카폴드 변환, 단
편항체 중심 기술
경쟁 |
- 높은 항체관련
특허장벽
- Extensive R&D
네트워크 요구 |
|
백신 |
- ’14년 200억 (10%)
- ’15년까지 과소공급
- 수급불일치 불확실성
- 치료면역 지속증가 |
- 세포생산 비용절감
- Universal 백신
- 질환치료 백신 |
- 10% 성장율/고성장
예상
- 중기 Hot Spot(이
머징) |
- 치료백신기술 상
대열위
- M&A, 공동연구,
SciBI |
|
분자
진단 |
- ’12년 212억 (22%)
- 개별영역 최대 50억
- 높은 시장집중도 |
- 지식융합 중요
- Up Stream 기술 |
- Integrative Model
- 신약개발 플랫폼
활용
- 기술수렴영역 |
- 국내기술 다양
분포
- 결합상품 개발
가능 |
|
줄기
세포 |
- ’15년 751억 (34%)
- 글로벌 벤처기업 등장
- Disruptive
/Emerging |
- iPS기술
- 분화조절 기술
- 면역억제 기술 |
- 높은 기술수렴도
- 높은 Novelty 요구
- 2세대 바이오신약 |
- 장기투자 필요
- Bank/미용 초
기사업화
- 정부 집중지원
대상 |
바이오의약시장의 변화
○ 2000년 이후 단백질 기반 1세대 바이오의약품은 임상성공율의 점진적 저하, 개발비용의 증가, 신규질환에 대한 후보물질 발굴 저하 등으로 인해 적용증 다변화, 약물 Redesign 등의 방식을 탐색하고 있다. 특히 단백질 의약품 중 가장 진보된 형태인 항체신약의 경우 항체단편 기술을 중심으로 신규 약물이 개발되고 있으며, 적응증 다변화, 약물설계 재디자인 등의 방식으로 니치마켓 타겟팅을 추구하고 있다.
○ 후발기업의 경우 특허가 만료되거나 만료예정인 1세대 바이오의약품의 복제품인 바이오시밀러(혹은 FOB) 개발에 주력하고 있는 반면에 대기업의 경우 차세대 항체 혹은 치료백신 등을 중심으로 한 2세대 바이오 의약품 개발에 주력하고 있는데, 2015년을 전후하여 바이오의약품이 합성의약품을 넘어 세계적인 주력의약품으로 등장할 것으로 예상되며, 그 중에서도 현재 임상을 진행중에 있는 각종 단편항체와 치료백신이 주류를 구성할 것으로 예상된다.
○ 2008년 12월 기준 미국에서 임상중에 있는 바이오의약품 중 백신, 항체, 호르몬이나 단백질, 유전자 치료제, 세포치료제 등이 급속하게 성장하고 있는 반면, 1세대 바이오의약품으로 간주될 수 있는 안티센스, 인터루킨, 성장홀몬 등은 현저한 감소세를 보여주고 있다. 특히 백신의 경우는 백신치료제에 고유한 면역기능과 동시에 면역기능을 이용한 질환치료제로서 암과 같은 난치성 질환, 조기질환 치료 및 완치율 상승을 목표로 백신 보조제가 갖는 다양한 특성을 활용한 신개념 제품개발로서 가장 뜨겁게 등장하고 있는 신규시장 영역이자 2세대 바이오의약품의 주류를 형성할 것으로 예상된다.
○ 2002년부터 2007년까지 바이오의약품 매출증가율은 16%, 백신 매출액은 19.3%로 2002년 전체 매출액중 바이오의약품 비중 9%에서 2007년 17%로 증가했다. 바이오의약품의 치료 메카니즘과 주사방식으로 투여되는 바이오의약품의 특성상 전문의 처방약의 증가율이 특히 높은데 2008-2009년 사이에 8% (바이오의약은 12%) 성장한 반면, 일반의가 처방한 약은 2-3% 성장한 것으로 나타났다.
○ 2006년 10억 달러 이상의 인수합병 7건으로 시작된 대형 인수합병 물결은 2008-2009년 사이에 모두 15건이 이루어지는 등 최고 정점에 오른 이후 2010년에도 계속되고 있다. 소규모 인수합병을 포함한 전체 M&A 건수는 2007년 109건에서 2008년 73건, 그리고 2009년에는 모두 344건으로 나타나 인수합병이 의약산업의 시장변화를 이끄는 중요한 변수로 역할하고 있다. 2000-2008년까지 진행된 대형 인수합병의 대표적인 사례는 화이저사가 자사 주력제품의 특허만료로 인한 매출감소와 바이오신약 부문에 대한 파이프라인 강화를 위해 680억 달러 규모로 Wyeth를 인수한 것으로부터 Roche사가 Avastin, Rituxan 등 바이오신약 기술역량 및 제품라인을 확보하기 위해 468억 달러를 지불하고 Genentech을 인수한 사실, 그리고 노바티스의 8억8천만 달러 규모 Speedel인수와 GSK의 7억 2천만 달러 규모 Sirtis인수 등이 있다. 특히 2008-2009년에 진행된 중소규모 인수합병의 특징은 매출증대가 주목적인 대형 인수합병과는 바이오 의약기술에 전문화된 고기술-현금부족 바이오기업들을 대상으로 진행된 것이다.
08-09년 대규모 인수합병 사례
|
인수자 |
제공자 |
업프론트 |
마일스톤 |
로얄티 |
임상단계 |
계약조건 |
|
화이저 |
머크 |
비공개 |
전임상 |
협력 |
|
화이저 |
Debiopharm |
비공개 |
3상 |
공동개발 |
|
노바티스 |
Incyte |
6천만 |
y |
y |
3상 |
공동개발, 공동프로모션 |
|
GSK |
Oxford
Biotherapeutics |
y |
3억7천만 |
y |
후보물질/전임상 |
공동개발 및 상업화 |
|
사노피 |
Merrimack |
6천만 |
7억4천만 |
y |
1상 |
라이센스인 |
|
엘라이릴리 |
BMS |
N |
|
|
1상 |
공동개발 |
|
머크 |
로슈 |
비공개 |
공동개발 |
|
BMS |
Exelixis |
1억90천만 |
4천5백만 |
y |
3상 |
개발 및 상용화 |
|
TAKEDA |
Alnylam |
1억 |
5천만 |
y |
전임상 |
공동개발 |
|
아스트라제네카 |
머크 |
비공개 |
1/2상 |
공동개발 |
|
UCB |
Wilex |
1천3백만 |
y |
y |
전임상 |
위험분담 파트너쉽 |
|
머크 |
Addex |
2천2백만 |
y |
y |
전임상 |
공동개발 |
|
J&J |
Vanderbilt
University |
1천만 |
1억 |
y |
전임상 |
라이센스인 |
|
로슈 |
PTC
Therapeutics |
1천2백만 |
10억 |
y |
기술 |
공동개발 |
|
BMS |
Otsuka |
4억 |
y |
y |
승인 |
상용화 |
|
엘라이릴리 |
NeuroSearch |
5백만 |
y |
y |
전임상 |
옵션계약 |
|
화이저 |
Medivation |
2억 2천만 |
5억 |
y |
3상 |
공동개발 및 상업화 |
|
노바티스 |
Vanda |
2억 |
2억6천만 |
y |
시판승인 |
상업화 |
|
GSK |
Neurosearch |
비공개 |
1억4천만 |
y |
전임상 |
라이센스인/상업화 |
|
아스트라 |
Targecept |
2억 |
5억4천만 |
y |
3상 |
공동협력/
라이센스인 |
|
J&J |
Elan Corp |
15억 |
- |
- |
다수 물질 |
공동개발/상업화 |
|
Sanofi-Aventis |
Alopex |
y |
3억7천만 |
y |
전임상 |
공동개발/옵션계약 |
|
Novartis |
Debiopharm |
비공개 |
- |
- |
2상 |
라이센스인 |
|
Novartis |
Paratek |
4억8천만 |
|
|
3상 |
상업화 |
|
Novartis |
Takeda |
1백만 |
y |
y |
EndtoEnd |
상업화 |
|
GSK |
Jiangsu
Walvax |
총 6천1맥만 달러 공동투자 |
endtoend |
조인트벤처 |
|
AstraZeneca |
Cubist Pharm |
비공개 |
시판승인 |
상업화 |
|
AstraZeneca |
Forest lab |
비공개 |
약물개발 후반기 |
공동개발/
상업화 |
|
Merck |
Mendarex |
6천만 |
1억6천만 |
y |
EndtoEnd |
공동개발/상업화 |
|
Roche |
Plexxicon |
6천만 |
2억7천만 |
y |
2상 |
라이센스인 |
○ 2007년에만 총 109건의 인수합병이 진행되었으며, 그 총 가치는 583억 달러. 일반적으로 인수합병의 목적은 매출증대, 파이프라인 보충, 리스크 공유, 지역적 확장전략, 비용절감, 경쟁력 강화, 하락하는 연구개발 생산성 제어 등의 목적이 있다. 이들 중에서 가장 핵심적인 근원이라고 할 수 있는 것이 연구개발 생산성 하락에 따른 파이프라인 고갈 문제 해결과 특허만료와 제네릭 의약품의 경쟁압력으로 인한 매출액 감소를 회피하기 위한 문제의식가 가장 강하게 작용하고 있는 것으로 나타났다. 특히 화이저-와이어스를 비롯한 대개의 메가 인수합병은 매출액 증대를 보다 직접적인 목표로 진행된 데 반해 로슈사의 제넨텍 인수, 아스트라제네카의 Cambridge Antibody Technology사 인수는 바이오의약품 분야를 중심으로 한 기업 비즈니스 모델의 전략적 전환, 선택과 집중을 위한 선택이었다고 할 수 있다.
특허만료와 연구개발 생산성의 약화
○ 데이터모니터에 따르면 2013년 의약산업의 매출액은 현재 추세대로라면 6,130억 달러이지만 신제품 출시의 감소로 인해 690억 달러, 바이오시밀러 진입 등 특허만료로 인한 매출감소 350억 달러, 그리고 약효 부작용이나 기타 사유로 인한 간접적인 효과 등으로 인해 780억 달러 등이 감소하여 총 4320억 달러 매출에 그칠 것으로 예상하고 있다. 이는 2010년 현재 총매출액이 4,300억 달러 내외인 것을 감안했을 때 시장성장이 향후 수년간 정체상태에 직면할 것임을 의미한다. 또한 2008년 이후 바이오산업 전체에 대한 펀딩위기가 지속되고 있으며, 최근의 상황은 더욱 악화되고 있음을 고려할 때 시장 전체적으로 통합, 구조조정, 전략적 재정위가 광범위하게 진행될 것임을, 비즈니스 모델의 전반적 변화가 불가피하며, 한동안은 불확실성과 구조변화의 흐름이 지속될 것임을 예고하는 것이다. 이에 반해 전세계적으로 의약품 매출액은 70년부터 2002년 사리에 약 11.1%로 증가하고 있어서 전체 수요대비 공급역량의 감소현상이 뚜렷해지고 있다. (경제성장율을 웃도는 매출액 증가율과 이에 대비해서 생산성 감소현상이 뚜렷해지고 있음은 앞으로도 빅샷이 항상 가능함을 보여주고 있는 것이다.)
○ 의약품 일반, 특히 바이오의약품은 2010년 현재까지 블록버스터 모델이 주류로 자리잡아 왔는데, 2002년 기준 58개 제품이 블록버스터 모델로서 전체 매출액중 1200억 달러가 이들 제품에서 발생했다. 이는 신약개발에 따른 장기 회임기간, 15억 달러 이상의 높은 연구개발투자로 인해 대량생산, 대량매출을 통해 투자대비 수익이 극대화될 수 있는 타겟질환에 주력한 결과이다. 이에 반해 니치모델을 선택할 경우 높은 연구개발투자비와 높은 실패위험을 커버하는 것이 원천적으로 불가능하기 때문이다. 하지만 이들 블록버스터의 대부분이 최근들어와서 특허만료 시점이 다가오고 있으며 테바나 산도스와 같은 시밀러-개량신약 기업들이 빠르게 성장하고 있어서 과연 블록버스터모델이 지속가능한지를 둘러싼 의문이 제기되고 있다. 이는 단지 바이오시밀러의 등장으로 인한 시장점유율 상실의 위기만이 아니라 분자진단 기술의 발전, 맞춤형 치료백신 기술개발, RNAi 등 유전자 치료제의 등장 가능성으로 인해 차세대 바이오의약 기술의 새로운 패러다임을 준비해야 한다는 전략적 차원에서도 비롯되는 것이다.
○ 2010년 화이저사의 Lipitor와 아스트라제네카의 Nexium 특허만료로 인한 약 116억 달러를 포함한 전체 281억 달러 규모의 매출감소, 2011년에는 아스트라제네카의 Seroquel 46억 달러와 BMS의 Plavix 81억 달러를 포함한 총 205억 달러 정도의 매출감소가 예상되고 있다. 이 정도 규모의 막대한 매출감소는 최근 심각해지고 있는 메이저 의약기업들의 연구개발 생산성 하락과 함께 장기성장성을 위협하고 있으며 최근 급증한 대규모 인수합병의 근본원인 중 하나이다. 이러한 대규모 인수합병을 통해 화이저는 심혈관 분야를 포기하고 중추신경 질환에 집중한 반면, 아보트는 진단기기회사인 AMO을 인수합병하는 방식으로 진단분야로 진출하고 있다. 또한 로슈사는 진단분야와 온콜로지 분야에 집중하고 있고, BMS는 소규모 바이오기업 흡수합병 및 자회사 설립을 통해 제품주력을 바이오로 포지셔닝하고 파머징 국가의 기업 흡수합병으로 마케팅 채널 확보하는 등 비즈니스 영역 확장에 나서고 있고, 아스트라제네카는 중국시장 등 파머징 국가의 시장진출을 위한 제조시설 구축하는 등 다양한 비즈니스 모델 전환이 이루어지고 있음을 확인할 수 있다.
○ Burill & Company에 따르면 전세계 의약기업의 연구개발투자비는 총 652억 달러로 추정되며 한 해에 개발되는 파이프라인에 들어있는 신약의 수는 모두 4,300여개, 그 중에서 최종 판매승인을 얻는 신약의 숫자는 08년 기준 24개에 불과하다. 결국 전임상에 진입한 후보물질 중 임상에 통과할 가능성은 0.5%라는 계산이 가능하며, 이러한 임상성공율은 각종 Omics의 진전, 연구개발투자비의 지속적 상승에도 불구하고 2004년을 제외하고는 지속적으로 하락세를 보이고 있다. 이에 따라 대부분의 의약기업들은 새로운 파이프라인을 가진 의약기업 인수합병, 바이오의약 전문기업과의 협력 혹은 인수합병, CRO-CMO활용, 전임상 단계에서의 후보물질 인수, 기초연구단계에서의 공동연구개발 등을 적극적으로 활용하는 한편, 기존 질환타겟에 대한 새로운 후보물질 발굴 혹은 신규 질환 타겟을 공략하는 차세대 신약개발에 나서고 있다. 신규 질환타겟을 공략하는 경우는 전체 개발 프로젝트 중 30% 내외를 차지하는 것으로 나타났다. 기존 질환타겟을 공략하는 신규물질의 경우 상대적으로 성공 가능성이 높은 반면에 신규 질환타겟의 경우는 임상성공율이 낮은 반면에 보다 큰 시장성을 가지는 경우가 대부분이고, 특히 질환의 유형으로 분류할 경우 CNS계열의 통증관련 치료제 개발이 다수를 차지하고 있는 것으로 나타났다. 이처럼 대부분의 거대 의약기업들은 보다 안전하고 단기적으로 생산성을 높일 수 있는 전략을 선택하고 있으며, 혁신적인 신약을 개발하는데 자금을 투입하기보다 포뮬레이션 변화, 적용증 확대 등에 더욱 주력하고 있다.
○ Datamonitor(2009, Overview)에 따르면 의약산업의 '07~'13년 연평균 산업성장율 2%를 기준으로 심혈관, 기관지계, 소화기계 항체신약이 5%, 감염성질환과 비뇨기질환, 근육기계 항체신약은 10%, 당뇨 및 면역기 질환과 종양질환의 경우는 15% 내외의 성장률을 보이는 반면에 단백질 치료제나 저분자의약의 경우는 4%에서 -6%의 성장률을 보일 것으로 예측하고 있다. 특히 많은 바이오 전문기업들은 향후 성장성이 높은 항종양 및 면역계 질환 항체신약 치료제 개발에 집중하고 있으며 '09년에만 임상시험에 들어있는 항체제품이 약 250여개 정도로 추정됨. 새롭게 적용되고 있는 항체기술의 경우는 Pegylation, Glycosilation와 같은 단백질 엔지니어링 기술, Fav나 Fc의 조작을 통한 단편항체, 결합항체와 같은 보다 진보적 개념의 기술, 더 나아가서는 완전히 새로운 스카폴드를 활용한 신제품 개발이 시도되고 있다.
○ 하지만 이들 바이오의약 전문기업과는 달리 거대 의약기업들은 크게 세 가지 서로 다른 유형의 비즈니스 모델을 추구하고 있는데, 첫째는 대학이나 병원, 혹은 기초원천 분야에 특화된 기업과의 공동개발 등을 통한 mRNA나 줄기세포에 기반한 차세대 치료제 개발을 시도하거나, 둘째는 기존 비즈니스 모델을 유지하되 후보물질 발굴 및 임상시험 프로세스의 합리화를 통한 생산성 향상을 추구하거나, 셋째는 인수합병을 통한 바이오의약 산업으로의 진출을 추구하는 것이다. 첫 번째 비즈니스 모델의 경우는 줄기세포를 이용한 차세대 치료제 개발을 위해 줄기세포 전문기업 혹은 대학내 줄기세포연구센터와 공동연구개발을 진행하고 있는 화이저와 GSK, 머크사 등이 대표적이다. 두 번째 비즈니스 모델과 관련해서는 블록버스터 모델이 가능한 다발성 암 질환인 유방암(612개), 전립선암(541개), 소세포폐암(414개), 결장암(298)개에 집중되어 있거나 니치마켓을 공략하는 경우는 우선 니치마켓을 공략한 후 이를 기반으로 유방암이나 전립선암 등과 같은 질환으로 적용증 확대를 통해 블록버스터로 진입하는 전략을 선택하고 있다. 이와 유사한 사례로는 어바스틴이 있는데 처음에는 결장암과 NSCLC 치료제로 사용된 후 Ovarain 암과 전립선암 치료제로 적응증 확대가 이루어진 것은 물론이고 앞으로는 거의 10여개 이상의 종양질환 치료제로 적응증 확대가 이루어질 것으로 예상된다. 세 번째 비즈니스 모델의 변화는 생산성 향상을 위한 제품개발 프로세스의 단계별 혹은 타겟영역별 아웃소싱 확대로 이어지거나 신규기술의 도입을 위한 대학, 기업, 공공연구소와의 개방형 연구개발 확대로 나타나게 된다. 이러한 협력관계의 확산은 초기기업간 거래가 가장 많이 이루어지고, 그 다음이 대기업간 거래, 대학이나 연구소와의 거래 순으로 진행되었으며 거래의 형태 역시 공동연구개발과 현금투입 혹은 라이센싱이 주종을 이루던 패턴을 벗어나 CMO나 CRO의 활용, M&A나 죠인트벤처 설립 등 다양한 형태로 분화하고 있다.
○ 타겟지향 의약 혹은 맞춤형 의약분야로의 비즈니스 모델 확장과 연구개발 생산성 향상을 위한 아웃소싱, 개방형 연구개발 시스템의 도입은 거대 제약기업들의 비용구조와 마케팅 전략에도 변화를 가져오게 된다. 특히 앞으로는 임상시험이 보다 복잡하고 엄격해짐에 따라 전체적인 임상비용과 기간은 높아지고 길어진 반면에 전임상 이전 단계에서의 연구개발 투자비중은 약 18%내외에서 25%, 초기 개발 비용은 17% 내외에서 30%로 늘어난 반면에 후기 개발비용은 22%에서 10%로 줄어들 것으로 예상된다. 또한 과거에는 전체 비용의 35% 정도를 차지하던 마케팅 비용은 13% 내외로 줄어드는 등 비용구조의 전반적 변화가 진행되고 있다. 특히 의약개발 프로세스 전반을 세분화하고 단계별 세그멘테이션을 병렬적으로 진행-관리하는 LifeCycle Management를 통해 임상단계에 들어있는 파이프라인의 병목현상을 해소하는 전략을 활용. 한편 임상성공률 제고를 위한 후보물질 발굴 및 약물설계를 위해 질환모델, Omics정보, 임상시험 결과분석, 약물대사 모델등과 관련한 광범위한 지식정보를 활용 약물개발 프로세스 전반의 최적화 설계 및 각각의 프로세스를 가장 효과적으로 수행할 수 있는 전문기업들을 연계, 생산, 판매하는 Virtual Firm Model이 확산되고 있으며, 거대 제약사들은 이러한 Virtual Firm Model을 내부 R&D 관리 툴로 활용하는 경우가 점점 늘어남. 또한 마케팅 및 관리비용 절감을 위해서 독자적인 영업망 대신에 마케팅 대행업체를 적극적으로 활용하거나 타겟수요자층에 대한 체계적인 관리, IT를 활용한 지식정보 시스템 활용 등이 보다 확대되고 있으며, 이를 기반으로 한 Virtual Firm 비즈니스 모델 역시 빠르게 확산되고 있다.
○ 연구개발 생산성 향상을 통한 비용절감, 글로벌 차원의 아웃소싱 확대강화, 의료관광을 넘어선 해외의료 서비스 시장의 확대, 그리고 바이오시밀러 등 제네릭을 통한 오리지날 대체경향 강화 요구는 여전히 지속될 전망이며 Genomics, Proteomics, Metabolomics 등 다양한 오믹스의 등장과 바이오 의료기술의 진보에 따라 각종 Omics를 활용한 조기진단, 맞춤형의약, 난치성 질환에 대한 신개념 치료/맞춤형 건강관리 등에 대한 요구가 높아지고 있다. 이에 따라 Personalized Medicine, Molecular Diagnostic, Health Informatics 기반 U-Health 등 새로운 비즈니스 모델의 등장이 본격화되고 있다. 특히 최근 들어 12년 이상의 장기간에 걸친 신약개발 프로세스, 높은 투자위험을 가진 의약개발 프로세스의 어려움을 극복하기 위해 기술개발 프로세스별로 전문화된 벤처기업 중심의 DBF가, 메이저 제약기업의 경우는 Integrative Business Model이 발전하고 있다. 이에 따라 바이오의약 산업에도 Open Innovation의 본격화, CMO등을 비롯한 글로벌 아웃소싱 시장의 빠른 성장, 기술중심의 M&A가 활성화되고 있음. 특히 이러한 과정에서 기업경쟁력의 핵심은 Technology를 넘어 Knowledge로 이동하고 있다.
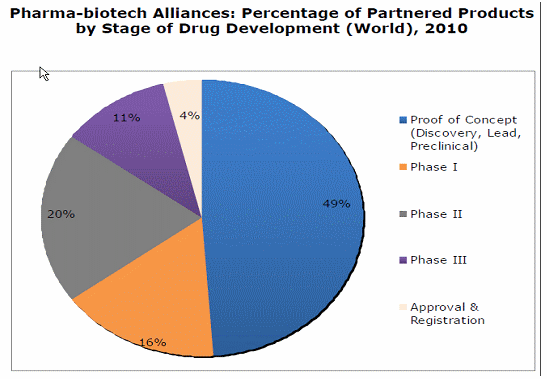
○ 2009년 기준 미국의 바이오벤처기업 중 파이낸싱이 안되는 바이오벤처 기업들이 55%에서 63%로 늘어났는가 하면, 6개월 이내의 여유자금밖에 안 가지고 있는 기업들은 41%에서 49%로 증가했다. IPO에 성공한 기업들은 2008년에는 하나도 없었고, 2009년에 단 한 개만이 IPO에 성공했다. 이 기간 동안 IPO에서 철수한 기업들은 2007년 57개에서 2008년 113개였다. 그리고 2000년 이후 IPO에 상장한 기업중 상장가 이상의 주가를 유지하는 기업은 11%에 불과한 것으로 나타났다. 이에 따라 바이오기업들에 투자한 투자자들 역시 투자금 회수에 보다 공격적으로 나서고 있는 것으로 나타났다.
○ 특히 바이오산업에서 투자자들의 기대수익율 10%+&을 가정할 경우 200년에 300억 달러의 매출을 기록하고 있는 바이오기업은 2008년에는 530억 달러 이상의 매출을 달성해야 주가유지 및 투자유치 흐름을 지속할 수 있게 된다. 그러나 2003년에 10억 달러 이상 매출액 제품이 53개였음에 반해 2008년에는 21개만이 블록버스터 모델에 해당하며, 앞으로도 이러한 경향은 당분간 지속될 것이다. (의약산업의 순수익마진은 03년 기준 21%, 투자수익율은 27%로 기록)
벤처캐피털 발전단계별 투자행태
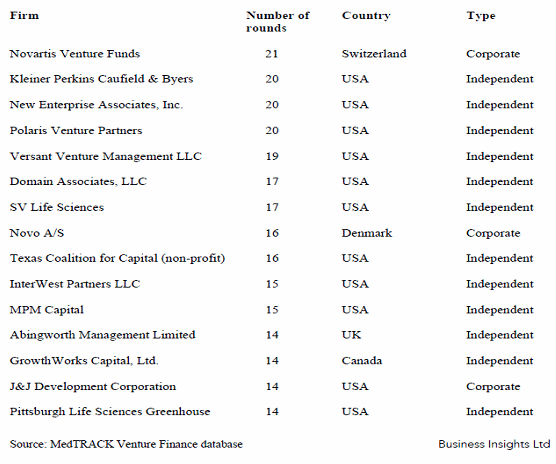
○ 바이오의약 기업에 대해 투자하고 있는 벤처캐피털 관련 주목할만한 흐름으로는 글로벌 제약기업이 출자한 바이오전문펀드의 투자가 최근 들어 급성장하고 있다는 점이다. 전세계 바이오벤처캐피털 상위 15개 중에서 노바티스, 노보노르디스크, 죤슨앤죤스 등이 3개를 차지하고 있으며, 노바티스 펀드가 가장 많은 투자를 진행한 것으로 나타났다. 노바티스펀드는 96년에 설립, 현재 5억 달러의 투자금을 운용중에 있으며 98개 기업체에 투자를 하고 그중 60개에 대해서는 주식참여가 이루어지고 있다. 노바티스펀드는 스핀오프, 스타트업, 바이오벤처펀드로 나누어서 운영 중이며 03년에만 600여건의 연계협력이 이루어지고, 그로 인한 거래액만도 300억 달러(Recombinant Capital, 2005), Aventis의 경우 전체 연구개발비중 15%를 연계협력에 사용중이며, 노바티스는 20-25%를 연계협력에 사용하고 있다.
연구개발 생산성 향상을 위한 노력
○ 세계적 차원에서 의약산업계는 2중의 난관에 봉착해 있다. 첫째는 2011-14년 사이에 최고조를 기록할 것으로 예상되는 특허만료로 인한 매출액의 감소분이 약 780억 달러 정도에 달하며, 2002년 이후 2014년 사이에 특허만료로 인해 상실하게 될 시장규모의 총량이 무려 1,200억 달러에 달한다는 사실이며, 두 번째는 2007년 이후 년간 승인되는 신약 건수가 24개 내외에 불과한 반면 연구개발 투자지출은 매년 빠르게 증가해서 2010년 현재 약 15억 달러에 도달하고 있다는 사실이다. 물론 새롭게 성장하고 있는 신흥시장의 성장률이 년평균 12% 정도를 기록하고 있으나 신흥시장에서의 신규매출 증가를 포함하더라도 의약산업 전체적으로 2000년대 경험해오던 약 3.1% 수준의 성장률 대신 0.7% 내외의 낮은 성장률을 경험하게 될 것으로 예상된다. 또한 미국 FDA를 중심으로 한 임상승인 절차의 투명성, 정보공개 확대, 승인기준의 엄격화 등으로 인한 규제압력과 함께 영국을 중심으로 한 약리효과의 경제성 검토 등 의약품 가격 하락 압력은 지속적으로 증가할 것으로 예상됨. 이에 따라 의약산업 전반에 대한 구조조정을 통합 생산성, 경제성 제고를 위한 다양한 시도가 진행되고 있다.
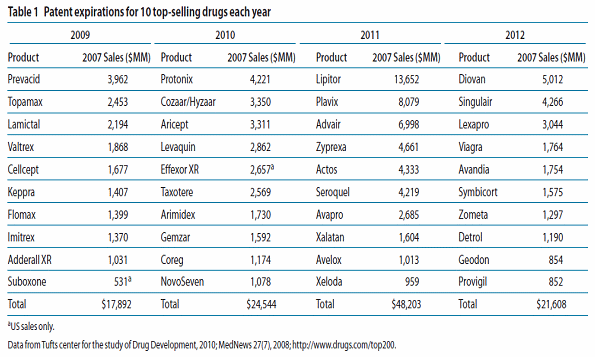
○ 일반의약의 세계시장은 09년에 770억 달러로 전체 의약시장 8,080억 달러의 9.5%정도를 차지하고 있으며 05-09년 연평균성장율은 약 10.3%로 추정되는데, 이는 브랜드의약의 성장률이 동 기간 6.0%를 기록했다는 점과 비교해 본다면 의약가격 인하압력으로 인한 일반의약 시장의 성장이 훨씬 빠르게 진행되고 있음을 보여주는 것이다. 특히 합성의약과 바이오의약 부문 모두에서 특허만료로 인해 생겨난 일반의약 시장에서 급격하게 성장하고 있는 Sandoz와 Teva의 경우 바이오시밀러 제품 분야에서도 세계적인 선두기업으로 성장한 것을 기반으로 바이오베터, 차세대 바이오의약품 시장을 공략하기 위한 시도를 진행하고 있음에 주목할 필요가 있다. 하지만 10-15년 사이의 연평균 성장률은 5.0%로 절반 가까이 떨어져 15년 기준 약 1,030억 달러의 시장규모를 차지할 것으로 예상되는데, 이는 주로 2011년을 정점으로 브랜드의약의 특허만료건수가 급격하게 하락하는데 기인하는 것이다.
○ 바이오의약의 경우 특허만료 건수가 2020년까지 일정하게 지속되는 반면에 합성의약의 경우는 2011년을 기점으로 절반 이상 줄어들다가 2015년에는 2010년의 1/5 수준으로 떨어질 것으로 예상된다(Pfizer사의 Lipitor 80억 달러, BMS사의 Plavix 70억 달러, Eli Lilly사의 Zyprexa 37억 달러, 그리고 Novartis사의 Diovan 20억 달러). 이 중에서 50대 제약기업들에 의한 바이오의약품 매출액은 2009년에 총 1,010억 달러를 기록했다. 이 중에서 11개의 제품이 각각 약 20억 달러 이상의 매출을 기록했는데 이는 2005년 630억 달러에서 년평균 증가율 12.6%의 성장을 거듭한 결과이자 2011년 이후 Amgen사의 Prolia가 16억 달러, Johnson & Johnson과 Pfizer사의 bapineuzumab가 10억 달러, GSK사의 Benlysta가 10억 달러 신규 블록버스터로 시장 출시가 예상되는 등 2015년까지 년평균 6.2%의 성장이 가능해져 약 1,450억 달러에 이를 것으로 전망된다.
○ 바이오시밀러는 2015년까지 약 32개 제품의 특허만료로 인한 매출액 손실이 510억 달러에 이를 것으로 전망. 하지만 특허만료로 인한 매출액 전부가 상실되는 것은 아니므로 바이오시밀러 제품의 시장점유율을 10-20%로 가정한다면 2015년 바이오시밀러 시장의 매출액은 총 50~100억 달러로 추정할 수 있음(데이타모니터 2015년 바이오시밀러 시장 추정치 35억 달러, Teva사의 2020년 추정치 750억 달러, Business Insight 20억 달러). 합성의약은 2011년 4,000억 달러와 2015년 3,910억 달러를 기록 점차 시장 규모가 감소할 것으로 예상되며, 이렇게 감소된 시장의 대부분은 항체신약과 백신신약이 대체할 것으로 예상. 이러한 대체현상은 바이오의약품의 우수한 약효 때문이기도 하지만 또 다른 한편으로는 특허만료로 인한 개량신약의 대체가 바이오의약품의 경우 더욱 어렵기 때문이기도 한 것에서 이유를 찾을 수 있음.
○ 연구개발 생산성 향상을 통한 비용절감, 글로벌 차원의 아웃소싱 확대강화, 의료관광을 넘어선 해외의료 서비스 시장의 확대, 그리고 바이오시밀러 등 제네릭을 통한 오리지날 대체경향 강화 요구는 여전히 지속될 전망이며 Genomics, Proteomics, Metabolomics 등 다양한 오믹스의 등장과 바이오 의료기술의 진보에 따라 각종 Omics를 활용한 조기진단, 맞춤형의약, 난치성 질환에 대한 신개념 치료/맞춤형 건강관리 등에 대한 요구가 높아지고 있음. 이에 따라 Personalized Medicine, Molecular Diagnostic, Health Informatics 기반 U-Health 등 새로운 비즈니스 모델의 등장이 본격화되고 있음. 특히 최근 들어 12년 이상의 장기간에 걸친 신약개발 프로세스, 높은 투자위험을 가진 의약개발 프로세스의 어려움을 극복하기 위해 기술개발 프로세스별로 전문화된 벤처기업 중심의 DBF가, 메이저 제약기업의 경우는 Integrative Business Model이 발전. 이에 따라 바이오의약 산업에도 Open Innovation의 본격화, CMO등을 비롯한 글로벌 아웃소싱 시장의 빠른 성장, 기술중심의 M&A가 활성화되고 있음. 특히 이러한 과정에서 기업경쟁력의 핵심은 Technology를 넘어 Knowledge로 이동하고 있다.
2. 파머징 국가의 성장
파머징국가 일반현황
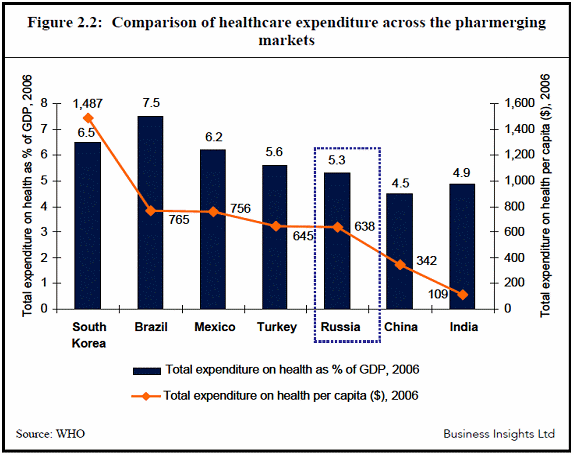
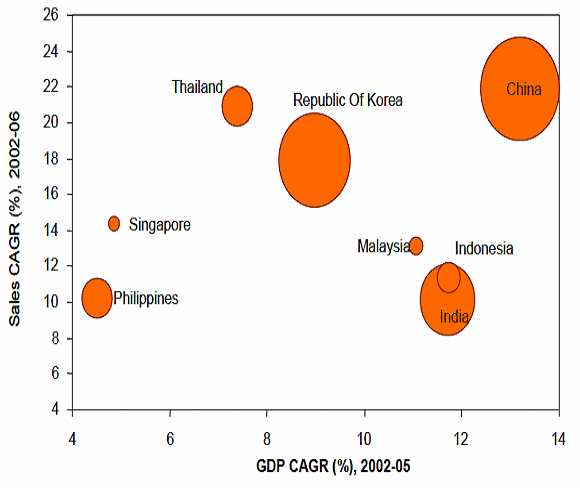
○ 파머징국가들에 대한 매출액은 2009년에 1050-1150억 달러로 2008년에서 2009년 사이의 증가율이 14-15%로 늘어났다. 이 정도의 증가율이 계속 유지될 경우 파머징 국가들이 전체 세계의약품 매출의 40%에 달할 것으로 예상된다. 파머징 국가들 역시 암, 당뇨, 비만 등의 질환이 급격하게 증가하는 동시에 인프라와 제도, 시장조건이 개선된 결과 파머징 국가의 시장성장이 가속화되는 것이다. 이에 따라 사노피 아벤티스나 화이저, 아스트라제넨카는 파머징 국가군에서 가장 큰 점유율을 자랑하고 있는 기업군들이며, GSK, Merck, Roche, Eli Lilly등이 새롭게 파머징 국가들에 대한 진출을 확대시키고 있다.
피마징 국가의 의료비지출 비교
○ 파머징 국가들에 대한 가장 큰 판매망을 가지고 있는 사노피아벤티스는 26%를, 노바티스는 22%, 화이저는 20%를 차지하고 있는데, 이들 대부분은 중국, 브라질, 인도, 러시아 지역에 대한 현지공장 및 연구소 설립을 추진하거나 이미 완료했다. 이들 기업군 중 파머징 국가들에 대한 가장 공격적인 진출전략을 구사하는 기업은 GSK로 인도나 아프리카, 중국 등의 지역에서 현지기업과의 연계, 합병, 마케팅 계약 등을 통해 현지진출 전략을 추진하고 있을뿐만 아니라 이집트, 파키스탄과 같은 비교적 후순위 파머징 국가들에 대한 현지진출도 역시 서두르고 있다.
파머징 국가군의 성장률 비교
○ Bayer Schering Pharma는 베이징 대학과 연계하여 1억4천만 달러를 투자해서 R&D연구소를 설립했고, 미국의 Pacific사는 CMO인 China Quatative Biomedicine과 디스포저블 생산시설(이 방면으로는 중국최대)을 이용한 생산계약 체결했다. 로슈사는 Chugai사와 협력관계를 체결해 지속해오고 있으며 어바스틴, Copegus, Tarceva, Xeloda, Herceptin을 일본에 출시했으며 미국에서 관절염 치료제인 Actemra를 임상시험 진행하고 있다. 아스트라제네카는 2008년에 중국내 현지생산시설을 확장구축하여 유럽시장에 대한 제품공급을 계획하고 있으며 중국과 인도 각각에 공급체인 관리를 위한 현지사무소를 설립했으며, 노바티스는 브라질에 생산시설을 확장하는 한편 중국에는 연구개발 센터를 설립하는가 하면, 화이저는 아시아 지역에 연구개발 및 생산역량 확장을 계획하고 있으며 머크사는 동유럽, 아시아, 러시아 지역에 임상활동을 확대강화하고 있으며 인도와 중국에서는 연구개발 센터를 설립했다.
○ 싱가폴에는 Abbott, GlaxoSmithKline, GSK Biologicals, Lonza, Lilly, Merck, Novartis, Pfizer, Sanofi-Aventis, Schering-Plough, Wyeth and Kaneka 등 외국기업이 입주해 있으나 자국 기업의 역량은 취약한 상태로서 바이오원캐피털의 투자를 받아 A-Bio사를 2003년에 설립하여 엔드투엔드 서비스를 제공하고 있으며 바이오프로세싱인스티튜트를 설립, 바이오프로세싱 전문인력을 양성하고 있다. 또한 노바티스와 제넨텍 역시 싱가폴에 현지생산공장을 설립할 계획이다.
파머징국가-중국
○ 중국은 실질소득 기준 세계 4위 국가이며, 무엇보다 년평균 성장률 10-12%를 몇 년간 이어오고 있는 명실상부한 세계경제의 선도국가이다. 뿐만 아니라 2030년 60세 이상 고령인구가 인구의 절반을 넘어서게 될 것으로 예상되고 있고, 소득수준의 전반적 상승에 따른 헬스케어 관련 수요의 지속적 증가로 인해 전세계 의약산업의 높은 관심이 집중되는 지역이다.
○ 중국의 의약산업은 1978-2005년 사이에 16.1%의 성장률을 기록했으며 2000-2005년 사이에는 19.4%로 최근 들어 더욱 빠르게 성장하고 있는 시장이다(Genetic Engineering and Biotechnology News, 2007). 특히 IMS Health는 중국의 의약시장이 2005년에 117억 달러 규모에서 2007년에는 160억 달러로 증가할 것이라고 예상했으나 Price Waterhouse Coopers에 따르면 이미 2007년 기준 200억 달러를 돌파한 것으로 나타났다. 이러한 추세가 계속된다면 중국의 의약시장은 2020년 기준 약 1,200억 달러로 세계 2위 시장으로 성장할 것이 분명해 보인다.
○ 중국에는 1990년 이후 거의 모든 다국적 제약회사가 죠인트벤처 혹은 공동협력, 연구센터, 생산시설 구축 등 다양한 형태로 진입했으며 연구개발부터 마케팅까지 전분야에 걸친 활동을 진행하고 있다. 중국내 의약품 중 12%는 수입, 63%는 자국내 생산, 그리고 25%는 다국적 제약기업과의 공동생산, 합작생산의 형태로 공급되고 잇다. 그러나 탑셀링 40-50%는 수입에 의존하고 있으며 전체 의약품중 95%가 제네릭으로 구성되어 있다. 중국에는 제약기업이 3,500개 활동하고 있으며 그중 90%가 중소규모이고 250개 기업만이 1,200만 달러의 수익을 올리고 있다. 국내기업 전체 중 35%가 국영기업이며 35%는 민간기업, 25%는 외국인 투자기업인데 외국인 투자기업은 05년 기준 약 1,700개 활동 중이고 전체 매출액 중 30%를 점유하고 있다. 그러나 시장독점도 측면에서는 상위 10대 기업이 전체의약품 생산액의 13%를 점유하고 있어서 선진국의 40-50% 점유율에 비해 훨씬 낮은 상태로 독점적 시장구조 는 아직 형성되지 않은 것으로 파악된다.
○ 중국내 대표적인 의약기업은 매출액 순위 기준으로 Harbin Pharmaceutical, Shijiazhuang Pharmaceutical, Shanghai Pharmaceutical, Tianjin Pharmaceutical, Yantze River Pharmaceutical, Jilin Xiuzheng Pharmaceutical, Guangzhou Pharmaceutical, Huabei Pharmaceutical, Tianjin Jinyao Pharmaceutical, Bayer-Schering Pharmaceutical 등이 있다. 중국의 생산기술 중 합성의약 기술은 세계적 수준에 도달해 있으며 첨단 의약물 중간체 기술을 보유하고 있으며 고급의약중간체 생산액은 120억 달러에 이fms다. 의약중간체 생산 상위기업으로는 Shijazhuang Pharmaceutical Group, Zhucheng Xingmao Corn Developing Company, Beijing Double Crane Pharmaceutical, Huadong Medicine, Anhui BBCA Biochemical, Yung Shin Pharmaceutical Industries, Shenzhen Neptunus Bioengineer, Zhejiang Sunrise Fine Chemicals등이 있고 이 분야의 성장률은 25%에 달해서 조만간 세계적 강자로 부상할 전망이다. 또한 중국 전통의약은 중국, 한국 등을 비롯해서 몇몇 나라가 특장점을 가진 분야인데, 전통의약기업은 1천개 정도 활동하고 있다. 바이오의약 부문은 400여개로 유전자조작의약 생산기업이 114개, 백신생산기업은 28개임. 생물의약산업은 01-05년 사이에 31% 성장했으며 백신생산의 경우 세계에서 가장 큰 생산능력을 자랑하고 있다(BMI, China Pharmaceuticals & Healthcare Report Q3 2010)
○ 현재 중국내 의약기업들은 국내시장 공략에 주력하고 있으며 선진국 시장진출에 필요한 기준을 충족하는데 어려움을 겪고 있기는 하지만 GMP 기준을 충족한 기업들을 중심으로 API 사업을 확대하고 있는 한편 (약 144개 기업으로 04-08년간 35% 성장) 바이오의약 부문의 CMO, CRO 사업이 빠른 속도로 성장하고 있다. 특히 중국내에 인도와 마찬가지로 FDA가 현지 사무소를 설립, 임상시험과 관련된 생산시설기준 등을 엄격하게 관리하고 있어서 세계적인 품질관리 역량을 확보하고 있고 이를 기반으로 향후 중국의 CMO, CRO 시장은 더욱 빠른 속도로 성장할 것으로 예상된다 (FDA 현지사무소 개설은 중국 2007, 브뤼셀 2007, 인도 2008, 코스타리카, 2009, 멕시코 2009년에 설립). 중국의 CMO전문기업으로는 Zhejiang Hisun Pharmaceutical, Shanghai Pharmaceutical (Group), Shandong Xinhua Pharmaceutical, Tianjin Pharmaceutical이 있는데 이들 대부분은 설비용량이 수요보다 커서 해외 수요자로부터의 주문경쟁이 치열해지고 있다.
○ 바이오의약 관련 첨단기술을 보유해야만 가능한 Drug Discovery Market에서는 WuXi PharmaTech(1억85백만 달러), ShangPharma(72백만 달러) Pharmaron(32백만 달러), Tigermed(30백만 달러), Venturepharm(6백만 달러)등이 대표적으로 활동하고 있는데 세계시장의 2%를 점유하고 있는 중국내 CRO 기업들이 선진기업들과의 공동협력, 제휴를 통해 DDS를 통합한 Sundia Meditech, United Pharmatech, HD BioSciences을 설립 운영하고 있으며 아스트라제네카나 미국의 Quintiles Transnational 역시 중국내 현지기업을 설립 운영할 예정이다. 이와 관련 중국내 바이오의약 부문의 특허현황을 살펴보면, 10개중 7개가 중국기업으로부터 출원되고 있으며 자국내 바이오의약 특허출원 성장속도로 보면 세계 최고수준이다.
파머징국가-브라질
○ 브라질은 남미시장 중 가장 큰 시장으로서 2009년 기준 인구 1억 94백만명, 개인당 실질소득이 1,597달러이다. 의료비 지출은 1,400억 달러로 GDP의 8.8%를 지출하는 것으로 알려져 있다. 인구1인당 년간 50달러를 의료비로 지출하고 있다. 브라질은 정부의 가격통제가 매우 심한 나라로 강력한 가격통제정책으로 인해 전체매출액은 최근 들어 약간 줄어들고 있는 현상이 일어나고 있으나 2000-2005년 사이 의약시장 성장률은 년평균 6%를 기록하고 있는 것으로 나타났다.
○ 브라질 의약시장은 2009년 기준 126억 달러로 년평균 성장률 11.6%를 기록하고 있으며 질환별 시장으로는 중추신경질환이 18%, 심혈관질환이 17.6%, 면역질환이 11.8%, 비뇨기질환이 12.7% 등이며 브라질에는 현재 370여개의 의약기업이 활동하고 있으며 그 중에 20%가 다국적 기업이고 Pfizer, Schering, Boehringer-Ingelheim, Bristol-Myers Squibb, Novartis, and Organon등이 대표적인 다국적 기업이다.
○ 브라질은 전세계 바이오다양성의 35%를 차지하고 있고 그 중에서 1% 이내만이 과학적으로 분석되었을 뿐이다. 또한 높은 경제적 불평등으로 인해 브라질 인구의 50%만이 현대의약에 접근할 수 있을 뿐으로 향후 잠재시장 가능성이 매우 높은 나라이다. 특히 세계 의약품 시장의 25%를 구성하는 남미시장의 관문으로 인식되고 있다. 브라질 국내 제약기업의 역량은 매우 취약한 상태이나 최근들어 정부의 강력한 지원을 통해 빠르게 성장하고 있는 추세를 보여주고 있지만, 여전히 다국적 기업이 시장의 지배자로 활동하고 있다. Sanofi-Aventis가 브라질에서 가장 큰 기업이며 Novartis와 Ache Labs이 그 뒤를 잇고 있다. 다국적 기업으로는 Novartis, Sanofi-Aventis, Pfizer, Bayer Schering, 그리고 Merck사 등이 있으며 국내기업으로는 EMS, Ache Labs, Medley, Eupharm, Castro Marques, N대 Quimica, Libbs등이 있다.
○ 브라질의 경우 정부가 의약생산 및 공급의 70%를 책임지고 있으며 빈곤층 의료서비스 제공을 위해 제네릭 생산이 년간 10%로 성장하고 무역블록내 국가들에 대한 수출 역시 2006년 이후 두배 이상 증가했다. 특히 정부의 의료평등 및 동등접근성 정책에 따라 다국적 제약회사와의 갈등이 벌어지고 있는데 정부는 1988년에 마련된 Sistema Unico de Saude (SUS ?the Single Health System)에 기반하여 약 5천만 브라질 인구에 대해 의료보험을 제공하고 있으며 의료보험 비대상자의 경우는 공공의료 시스템을 통한 의료서비스 제공이 이루어지고 있다.
○ 하지만 브라질의 경우 기술혁신을 위한 글로벌 연계협력 측면에서는 파머징 국가군들 중에서 가장 취약한 국가 중의 하나인데, 특히 브라질 정부는 에이즈 관련 치료제에 대한 강제이행명령을 자주 사용했는데, 이를 통해 수입의약품의 가격은 7.2%, 브라질 생산의약품은 72% 정도 약가 인하 효과를 달성했다. 또한 지적재산권 관련 법-제도가 취약하고 지재권에 대한 사회적 인식 역시 상대적으로 약한 측면이 있어서 다국적 기업의 직접 현지진출 외에 주목할만한 국제공동연구 등은 매우 소수에 그치고 있다. 브라질의 지적재산권법은 1997년에 국제기준에 맞는 법개정이 이루어졌으며 이에 따라 20년간의 특허보호기간 및 10년간의 시장독점권이 인정되고 있다. 국제공동협력을 위한 세제지원 및 연구협력 촉진지원책은 2005 2006년에 각각 제정되어 운용되고 있으나 여전히 상대적으로 많은 제약이 존재한다.
○ 글리벡, 휴미라, 허셉틴, 레미케이드 등 특허권이 설정된 바이오의약품의 성장률은 9.7%이며 브라질 바이오시밀러 시장은 총 2억 달러 규모로 인도의 바이오시밀러기업이 50% 이상의 시장점유를 달성했는데 이들 인도기업은 Human Insuling은 1.8달러, 인터페론 알파는 1.05달러, Epotein은 0.5달러의 가격으로 판매되고 있다.
파머징국가-러시아
○ 러시아는 인구 1억 4천만명으로 국민실질소득이 2009년 기준 15,000달러이고 인구의 13%가 노령화 세대이며 경제적 어려움으로 인해 인구증가율이 감소세를 기록하고 있다. 전체의약시장 규모는 2005년 기준 90억 달러, 2007년 105억 달러, 2009년 153억 달러로 2004-2008년 년평균 성장률이 20-30%로 매우 빠르게 성장하고 있는 나라이다. 하지만 대부분의 의약시장이 다국적기업에 의해 지배되고 있으며 자국의 의약관련 기술수준은 선진국에 비해 약 15-20년 이상 뒤져 있는 것으로 조사되고 있다.
○ 러시아 의약시장은 과점상태라고 할 수 있는데 상위 10여개사가 전체시장의 36%를 점유하고 있으며, 노바티스사가 전체 시장의 6.3%를 차지해서 1위 기업으로 활동 중이고 Sanofi-Aventis가 2위 기업으로 2008년 매출액이 3억 15백만 달러, Servier가 3위 기업으로 매출액 2억 33백만 달러를 기록하고 있다.
○ 러시아 의약시장 역시 다국적 기업에 의해 지배되고 있는데, Novartis/Sandoz/Lek, Bayer Schering, Sanofi-Aventis, Servier/Egis 등이 상위기업체이지만 러시아 현지내 생산시설 및 연구시설에 대한 투자는 아직 매우 취약한 상황이다. 이에 반해 제네릭 전문기업인 Teva사는 1억 달러 규모의 생산시설을 구축할 예정이며 헝가리의 제네릭 기업인 Egis 역시 모스크바에 생산시설을 구축할 계획이고, 스위스 기업인 Nycomed는 Yaroslavl 지역에 현지생산 시설을 구축하고 있다. 독일기업인 Stada는 러시아 국내기업과 헝가리 의약기업들에 대한 인수합병을 통해 러시아 시장에서 가장 공격적인 투자를 진행하고 있는데 인도의 바이오의약기업인 Celon Labs과 함께 현지 바이오의약 종양치료제 생산을 추진중에 있다.
○ CRO와 CMO분야의 경우 2009년 모스크바 대학 생물학과의 지도하에 모스크바 근처 Dubna에 25백만 달러 규모의 새로운 임상시험센터가 설립되었는데 주로 외국 제약기업의 계약형주문생산을 통해 2015년 52백만 달러 매출을 달성한다는 목표를 가지고 있다. Amgen은 2007년부터 임상시험 센터 설립을 추진하고 있으며 특히 국내임상 201건을 포함 미국, 독일, 영국, 그리고 스위스 제약사들의 임상시험이 53%를 구성하고 있다. 기업들로는 Novartis, Sanofi-Aventis, GlaxoSmithKline, Pfizer, Merck 등이 대표적이다. 러시아 자국 기업으로는 Valenta, Biocad, Sintex, Stadaowned Nizhpharm, Niopik 등이 있다.
○ 러시아 정부는 과거 소연방 시절의 우수한 연구개발 인력과 연구시설을 활용해서 세계적 경쟁력을 가진 첨단의약 개발 및 생산역량을 구축하는데 집중지원하고 있는데, 국가 소유의 Rosnano사는 1억 3천만달러 규모의 투자를 통해 malignant neoplasms 치료제로 나노의약품 생산기술 개발을 추진하고 있으며, 러시아 최초의 상장의약기업인 Pharm-Sintezs는 의약최종재 생산에 특화된 기업으로 바이오의약 분야에 진출을 준비하고 있다. 또한 러시아 기업인 Gerofarm은 덴마크의 NNE Pharma와 영국 컨설팅 그룹이 협력하여 GMP기준을 충족하는 6개의 생산시설을 구축, 주문형 계약생산을 진행하고 있다. 바이오의약 부문으로는 Human Stem Cell Institute (HSCI)가 2010년 12월에 4백만 달러 규모의 상장을 추진중에 있으며 Pharmstandard는 2007년 상장 이후 신종플루 치료제 판매로 크게 성장했고, Arbidol 역시 Velcade (bortezomib) 판매로 성장세를 이어가고 있다.
파머징국가-인도
○ 인도는 1조 2천억 규모의 GDP를 가진 세계 12위권의 국가로 년평균 성장률은 8-10%이다. 인도의 의약시장은 2008년 기준 100억 달러로 75억 달러가 일반의약품이고 30억 달러가 전문의약품으로 추정된다. 의약품시장의 성장률은 년평균 8%로 인도제약기업은 이미 저개발국과 유럽선진 시장에서 일반의약품 관련 경쟁력을 확보하고 있다. 특히 Ranbaxy, Dr Reddy’s Labs, Wockhardt, Cipla, Nicholas Piramal, Lupin등은 미국 FDA 승인된 생산시설을 보유하고 있으며 CMO, CRO분야에서도 선진국과 동등한 수준의품질관리 기술력을 보유하고 있어서 세계시장의 30%를 점유할 것으로 예상되는 등 빠른 성장을 경험하고 있다.
○ 인도의 바이오의약산업은 2010년 50억 달러 규모의 시장을 형성하고 있으며 2005-2007년 사이 연평균 성장률은 35%로 대단히 빠르게 성장하고 있다. (BMI Reports, 2010). 하지만 인도의 의약기업들은 기술혁신에 대해 선진국에 비해 대단히 인색한 편으로 전체 매출액의 0.5%만을 연구개발 투자로 사용하고 있는데, 대표적 기업인 Ranbaxy는 4%, Cipla는 4.4%, Dr Reddys Labs은 4%, Torrent Pharma는 6.4%, Lupin은 1%, Workhardt는 10%를 투자하는 것으로 나타났다. (Datamonitor report, 2005, “India’s growth prospects in pharma)
○ 인도의 바이오의약기업은 350여개로 그중에서 50%는 제품개발, 20%는 임상개발, 15%는 연구개발서비스, 그리고 5%는 플랫폼 기술에 집중하고 있다. 그 중에서도 대표적인 기업인 Biocon은 발효전문기업으로 바이오의약산업에 진출하였으며 최근 계약형 약물발굴과 임상시험 대행을 전문으로 하는 Syngene과 Clinigene를 각각 자회사로 설립하였으며 Reliance Life Science사는 바이오시밀러에 주력하고 있는 기업으로서 API 전문생산시설을 구축하고 있다. CMO회사인 Kemwell은 방갈로에 5천만 달러의 생산시설을 구축하고 있으며 CResearchO, CMO 분야에 특화된 기업이다. Actis Biologics사는 말레이시아 정부와 협력하여 말레카에 바이오시티 과학단지를 건설하고 있는데 50:50의 죠인트벤처투자사를 설립하여 엔자임치료제, 세포치료제, 면역치료제 등에 집중하고 있다.
3. 연구개발 생산성의 위기
생산성 위기 현황
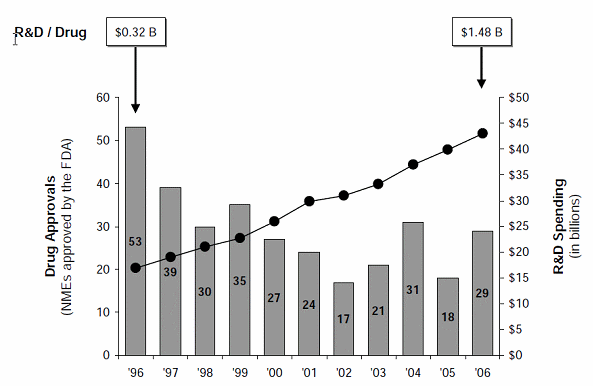
○ 1999년에 1,800개의 신약이 개발 파이프라인에 들어 있었던 반면에 2010년에는 2,950개로 늘어나 10년만에 약 2배로 증가한 반면에 연구개발 비용은 합성의약의 경우 1990년에 20억 달러, 2009년에 458억 달러로 20배 증가했음. 투자대비 연구개발생산성이 대단히 느리게 성장하고 있음을 보여주고 있다. 또한 1996년 판매승인을 받은 신약이 53개였던 반면에 2006년에는 29개, 2009년에는 24개로 줄어든데서 볼 수 있듯이 후보물질 대비 임상승인 비율은 해를 거듭할수록 줄어들고 있음을 확인할 수 있다.
연구개발투자액 대비 임상승인건수
PharMa, 2007
○ 2000년 이후 연구개발 비용이 14% 증가한 반면, 임상성공율은 20%에서 8%로 하락하는 등 의약개발 비용 및 성공률 하락은 2000년대 이후 더욱 심화되고 있다. 뿐만 아니라 FDA에 의해 승인된 신약이 과거 5년 평균에 비해 50% 이상 줄어들고 있으며 08년에 승인된 신약 21개 중에서 6개만이 15개의 거대제약사들에 의해 개발되었고, 그 중에서도 정말 신규성이 인정된 신약은 17% 즉, 4개에 불과하다는 점을 주의할 필요가 있다(통상평균은 년간 5-6개). 이는 최근들어 급증하기 시작한 연구개발투자비(18억 달러)의 증가율을 고려할 때 연구개발 생산성의 위기가 단순한 일과적 위기가 아니라 패러다임의 전환을 요구할만큼 심각하고 구조적인 차원의 위기임을 보여주고 있는 것이다.
임상단계별 탈락비율
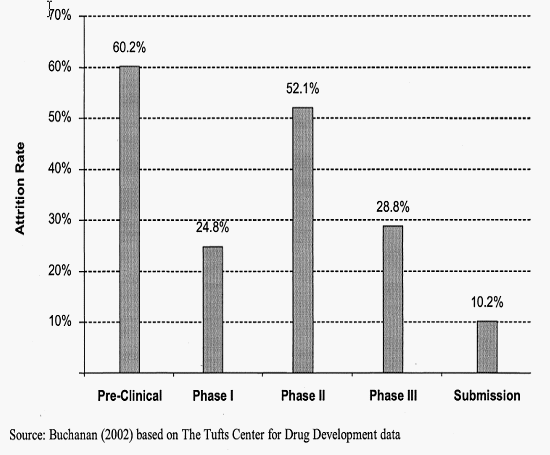
○ 특히 비용 및 생산성에 가장 큰 영향을 미치는 단계는 2상과 3상, 그리고 후보물질 최적화 분야인데 최근의 경향을 보면 오히려 2상과 3상에서의 실패율이 높아지고 있음. 보다 구체적으로 살펴보면, 개발중인 의약품의 38%가 임상1상에서 폐기되고, 임상2상의 63%가 Efficacy 문제로 탈락하며 45%가 임상3상에서의 실패율은 45%, 임상통과된 제품 중 23%가 시판승인을 얻지 못하는 상황임. 물론 이러한 임상시험 실패 가운데에는 약효나 부작용에 관련된 문제 외에도 타겟질환 시장이 충분하게 성장하지 않거나 혹은 시장내외적 조건 변화에 따라 블록버스터로 성장할 가능성이 사라짐에 따라 개발사 스스로에 의해 취소되는 경우도 있기는 하지만 파이프라인에 들어있는 신약후보 중 최소 약 80% 이상이 기술적 이유로 인해 시판승인을 얻지 못하고 있음
○ 바이오의약산업의 세계적 선진국인 미국 바이오의약산업계에서 조사한 Pharmaceutical Research and Manufacturers of America, PhRMA Annual Membership Survey, 2010에 따르면 회원사 전체가 연구개발비로 투자한 비용은 총 473억 83백만달이며, 이를 개발단계별로 나누어보면 전임상 이전에서 12795백만 달러(27%), 1상에서 2889백만 달러(8.2%), 2상에서 6089백만 달러(12.9%), 3상에서 15407백만 달러(32.5%), 승인에서 2225백만 달러(4.7%), 4상에서 6835백만 달러(14.4%), 미분류에서 139백만 달러(0.3%)로 나타났으며 바이오의약 유형별로는 단백질이 10,542백만(22.2%), 백신이 1,600백만(3.4%), 세포 혹은 유전자 치료제 176백만 (0.4%), 기타 바이오의약품 1,337백만 달러(2.8%)로 나타났음. 이를 바이오의약 한 개를 개발하는데 필요한 투자비용을 개발단계별로 나누어 살펴보면(고정자본 투자비용을 제외한 운영자본 비용으로만), 타겟발굴 단계에서 전체 투자비용의 3%인 24백만 달러, 후보물질 발굴 단계에서 6%인 4억 90백만 달러, 후보물질 최적화 단계에서 17%인 1억 46백만 달러, 전임상 단계에서 7%인 62백만 달러, 임상 1상에서 15%인 1억 28백만 달러, 임상 2상에서 21%인 1억 85백만 달러, 임상 3상에서 27%인 2억 35백만 달러, 출시단계에서 5%인 44백만 달러가 투입되는 것으로 나타났다.
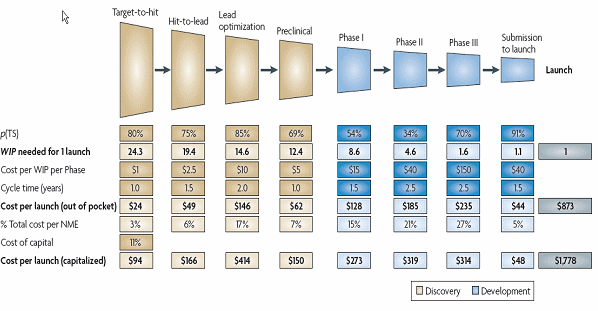
○ 미국 FDA에 따르면 ‘09년 임상실험에 들어간 신약개발 제품은 총 2,900개 이고 이중 300개가 희귀질환, 750개가 암치료, 277개가 심장질환이나 중풍, 109개가 HIV/AIDS 치료제로 나타났으며 글로벌 제약기업의 경우 개별 기업당 임상 파이프라인에 들어있는 신제품의 개수는 20여개 내외 인 것으로 나타났다. 통상 1개의 신약출시를 위해 9개의 임상 1상 제품이 필요하다고 했을 때 (10% 내외의 성공률 가정) 1년에 2-5개의 신약을 출시하려면 약 18-45개의 후보군이 임상1상에 존재해야 한다. 또한 1개 신약 출시를 위해 후보물질은 20개, 후보물질 최적화는 15개가 필요하다고 할 경우 2-5개 신약출시를 위해서는 각각 40-100, 30-60개가 필요하다는 계산이 가능하다. 하지만 이 정도의 신약개발 생산성은 제아무리 큰 제약사라해도 달성하기 어려우며, 이러한 연구개발 생산성의 하락이야말로 거대제약사들의 수익성 악화를 불어오는 원인이고, 글로벌 제약사들이 아시아 각국에 대해 후보물질 License In, 개발 초기단계 제품들에 대한 적극적인 라이센싱 전략에 나설 수 밖에 없는 근본적 이유라고 할 수 있다. 특히 글로벌 제약사가 바이오벤처기업을 인수합병하면서 입수합병 대상기업의 가치가 지속적으로 상승하고 있는 것 역시 수요와 공급의 불균형 측면에서 찾아볼 수 있다 (최근 급격하게 증가하고 있는 M&A는 연구개발 생산성의 위기라는 구조적 차원의 요구와 함께 바이오벤처기업의 경우 ’08년 이후 본격화된 경제위기로 인한 자금상황의 압박으로 다양한 Exit 확보의 필요성이 높아지고 있는 측면을 반영한 것이기도 하다. 따라서 바이오벤처기업의 경우 기술력을 기반으로 글로벌 기업에 대한 협상력을 높일 수 있는 적극적인 전략기획 필요)
기술적 측면
○ 기술적 측면의 경우 첫째, 타겟발굴 및 선별의 경우 질환메카니즘에 대한 정확한 이해에 기반하지 않고 기존의 임상적 경험과 초고속검출 방법을 활용한 유전자 혹은 단백질 수준의 통계적 확률에 기반해 있어서 그 정확성이 낮으며, 임상단계 이전에 Efficacy와 Side Effect를 검증하는 단계에서 동물질환 모델을 사용하는 것이 일반적인데, 그 검증 가능성이 50%를 넘지 않아서 실질적인 검증효과를 기대하기 어렵다는 점이다. 핵심적인 문제는 우리가 질환의 일차적 원인에 대한 이해가 매우 부족한 상태라는 점에서 찾을 수 있다. 우리가 알고 있는 것은 병변진행의 최종결과, 혹은 이미 검증된 치료제의 작용 메카니즘으로부터 추정하는 방식으로 이루어진다. 그러나 우리는 현재 병변진행의 단계적 이행에 대해서조차도 충분히 이해하지 못하고 있는 상태이며, 기왕에 검증된 치료제는 대개 우연의 결과로 얻어진 것이다. 이런 점에서 질환-치료메카니즘에 기초한 타겟셀렉션은 physiological pathway에 기초한 것이 아니라 추측에 의존하고 있다고 보는 것이 보다 올바를 것이다(현재까지 밝혀진, 검증 가능한 타겟은 100여개이다). 현재 주로 사용되는 고속검출법은 수십만 달러의 비용과 일년 이상의 시간을 들여서 수만개의 약물타겟 중 하나 혹은 서너개의 유효타겟을 선별해 낸다. 이렇게 선별된 후보 중 높은 친화성, 신체내 흡수 및 분산특성, 비용효율적 제조가능성, 신체 및 유통과정에서의 안정성 등을 기준으로 2차 선별에 들어가며 이 과정에서 역시 높은 비용과 시간이 투자된다. 왜냐하면 구조적 변이체 제작과 이를 실험실 및 동물실험을 통해 검증해야 하기 때문이다. 이러한 반족적인 검증실험은 수년 동안 지속되며 그 결과 전임상 타겟물질이 얻어지는데, 전임상 통과율이 매우 낮은 것은 익히 알려져 있다. 물론 지난 연구결과를 통해서 임상1상 보다는 2상에서의 실패율이 높아지기는 했으나 전체적으로는 7백만개의 컴파운드 중 1개가 임상을 통과하며 전체 기간은 8-12년, 비용은 12억 달러에 이르는 것으로 나타나 있다.
○ 이와 관련 떠오르고 있는 대안은 시스템생물학과 페노타입 익스트림 캐릭터라이제이션 접근법으로 나눌 수 있다. 시스템 생물학은 환자의 세포나 혹은 유체들로부터 수집된 샘플의 비교분석을 통해 얻어진 각종 오믹스의 연구성과를 토대로 복잡한 상호작용 네트워크를 분석하는 방법으로 이루어지는데, 질환관련 대사경로가 교차하는 지점을 중심으로 질환타겟을 선별하게 된다. 이러한 방식의 접근법은 현재까지는 대개 온콜로지에 제한되어 있었는데 다른 영역에 확장하는 것은 여러 가지 개념적 기술적 문제들로 인해 어려움에 봉착해 있으며, 특히 적절한 시점에 적절한 질환세포를 확보, 연구하는 것의 어려움도 극복해야 할 문제 중 하나이다. characterization of extreme phonotype의 경우는 유전질환 치료메카니즘을 통해 타겟선별을 하는 것이다. 유전질환의 경우에도 환경과 후성적 요인으로 인해 복잡성이 진화하게 되며 이로 인해 지노타입과 피노타입으로의 분화가 일어난다. 하지만 여기서 주목해야 할 것은 유전질환은 통상적 질환과는 달리 그 원인이 분명하며 치료효과도 분명하게 구별된다는 특징이 있다. 따라서 유전질환의 메카니즘과 피노타입으로의 진화메카니즘 분석을 통해 통상적 질환의 메카니즘 혹은 타겟물질을 분석해내는 것이다. 대표적인 사례가 유전질환의 일종인 atheroscleorosis에 대한 연구로부터 콜레스테롤저하제인 statin을 개발해 낸 것이다. 최근 이러한 접근법과 관련하여 알츠하이머질환과 amyloid deposition in presenile dementias를 대조하는 연구가 활발하게 수행되고 있다.
○ 둘째, 질환메카니즘에 대한 이해의 부족에 더하여 문제를 더욱 어렵게 만들고 있는 요인은 유전체 정보에 대한 우리의 지식이 아직은 상당히 부족한 상태라는 사실이다. 분자생물학자에 의해 제안된 거의 모든 타겟물질들은 10년전에는 이름조차 존재했던 적이 없었던 반면에 이들 물질의 생물학적 이해, 그리고 인간질환에서 차지하는 역할과 메카니즘을 밝히기 위해서는 10년 이상의 연구가 필요하다는 점을 고려할 때 더욱 분명해진다. 또한 동물모델은 대사 메카니즘에서 인간과 아주 많이 다르며 인간의 질환 메카니즘과 관련된 다양하고 복잡한 양상 대신에 소수의 몇가지 측면만을 보여준다는 점에서 독성, 효과성, 부작용 등과 관련된 문제를 항상 안고 있다. 이는 전임상-임상-승인에 이르는 과정의 성공률이 15%하라는 사실에서도 증명된다. 또 하나 잊지 말아야 할 사실은, 현재 우리는 인간 유전자의 40%(8천개)에 대해 파악하지 못하고 있으며, 40% 수준의 미확정성을 가지고 질환 혹은 대사 등과 관련된 시스템 모델을 수립하는 것은 매우 어려운 일이다. 따라서 현재 수준에서는 의약개발 생산성 향상 혹은 바이오마커를 이용한 예측의학이 발전할 수 있는 최선의 방법은 나머지 유전자에 대한 분석인데, 이를 위해서는 connect to decode같은 방식을 활용하는 것이 효과적이다.
○ 셋째, 질환모델에 기초하여 정확한 타겟셀렉션을 하는 방법이 보다 근본적인 차원의 문제라고 한다면, 보다 직접적이고 조기에 구현이 가능한 또 다른 방법으로는 임상성공율을 높이거나 임상진행 단계에서 타겟환자군을 선별하고 임상 검증포인트(End Point)를 약물특성과 질환특성에 맞게 설계함으로써 보다 짧은 기간내에 임상을 성공적으로 진행하는 한편 성공율을 높이는 전략을 추구하는 것이다. 이를 위해서는 보다 체계적이고 대규모적인 임상의학정보의 축적, 관리, 가공, 지식전환 역량을 필요로 하는데 반해 이 분야의 기술적 역량이 초기 수준에 머물고 있다는 점이다. 특히 전체 개발비용의 63%를 차지하고 있는 임상단계에서의 성공률이 15% 내외라는 사실을 고려한다면 연구개발 생산성 확보를 위해 집중적으로 노력을 기울여야 하는 부분은 Efficacy와 Side Effect에 관련된 불확실성을 최대한 낮추고 임상진입 이전에 해당 개발 프로젝트의 지속 추진 여부를 조기에 판정하는 것이 매우 중요하다. 물론 이러한 문제를 근본적으로 해결하는 길은 타겟선별, 약물설계 단계에서 질환 메카니즘과 Omics간의 관계를 시스템적인 관점에서 보다 정확하게 이해하고 설계하는 것이 매우 중요하다. 하지만 이는 단기적으로 해결될 수 있는 성질의 과제가 아니다. 따라서 단기적으로 임상성공율을 제고하기 위해서 주목해야 할 부분은 바이오어베일러빌러티가 아니라 (원인의 20% 이하), 효력이나 안전성 마진 부분을 최대한 좁히는 것이다. 이와 관련되어 최근 몇 년 사이에 주목을 받으며 빠르게 성장하고 있는 분야가 바로 바이오마커를 활용한 조기진단, 약효검증 기술의 발전이다. 바이오마커를 활용한 약물개발의 성공가능성, 특히 임상단계에서의 실패율을 절반으로 줄일수만 있어도 약 2억 70백만 달러의 비용절감이 가능하다. 이것이 바로 흔히 말하는 중개의약 연구의 목표라고 할 수 있다. 중개의약은 그 개념이 지나치게 넓게 사용되고 있는데, 가장 적절한 좁은 정의는 진임상의 결과가 임상결과로 이어질 수 있는지를 검증하는 일련의 기술 혹은 프로세스를 지칭하는 것이다. 다시 말해 분자마커와 모델시스템을 사용해서 약물에 대해 긍정적으로 작용할 것으로 예상되는 대상환자군의 선별 및 모집, 약동력학과 약역학에 기초한 처방방식의 설계, 그리고 처방에 다른 치료효과의 정확한 감별 및 진단과 관련된 내용이 중개의학이라고 정의될 수 있다. 이러한 중개의약의 발전은 임상2상에 진입하기 이전에 후보물질에 대한 점검을 통해 임상2상에서 실패할 확률을 대폭 낮추어주는 역할을 행하게 되는데 이는 임상비용과 기간을 줄여준다는 장점을 가진다.
비즈니스적 측면
○ 비즈니스 모델과 관련된 문제점을 살펴보면, 첫째, 글로벌 시대에 의약산업의 서로 분리독립되어 운영되는 분할된 프로세스 설계와 각각의 발전을 가로막는 가장 큰 장애물은 단일 기업내에서 프로세스를 선형적으로 관리하는 행태라고 할 수 있다. 글로벌 제약사의 전형적인 개발 프로세스는 블록버스터가 될만한 타겟질환을 먼저 선정한 뒤 해당 질환과 관련된 유력한 타겟물질을 선별, 임상시험을 진행하는 방식으로 이루어진다. 이는 임상의학적 지식에 기반한 기술적 가능성을 중심으로 물질을 개발, 임상에 진입하는 방식과는 전혀 다른 것이다. 특히 이러한 과정이 선형적으로 진행됨에 따라 전체 개발기간이 길어지는 효과를 낳게 될 뿐만 아니라 각 단계를 이행함에 따라서 얻어지는 축적된 지식이 환류되지 못한다는 문제를 가지게 된다. 이러한 일련의 과정을 폐쇄-선형적 모델이라고 한다면 Open-Parrarell 방식의 경우 파이프라인에 들어가는 후보물질이 해당 기업내부에서 개발된에 국한되는 것이 아니라 전세계에서 개발된 후보물질을 선별하는 방식으로 진행되며, 타겟질환을 중심으로 연관된 다양한 후보물질 포트폴리오가 병렬적으로 진행됨에 따라 하나의 후보물질 개발과정에서 얻어진 지식이 곧바로 다른 후보물질에 적용, 그 정확성이나 성공가능성을 높이는 데 활용하거나 동시에 다수의 후보물질을 개발하는 라이프사이클 매니지먼트 역시 가능해진다. 뿐만 아니라 병렬- 순환형 모델의 경우 동일한 물질을 사용한 다양한 질환타겟을 공략하는 멀티버스터(Multi-Buster) 모델 역시 운용 가능하다는 장점을 가진다.
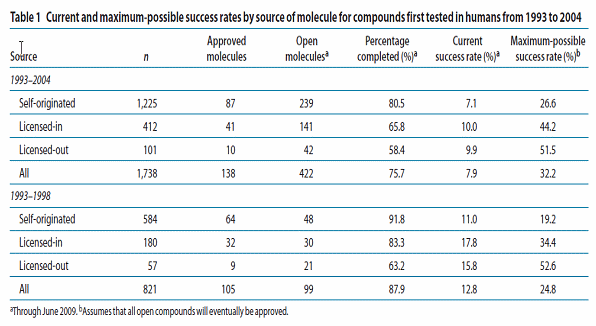
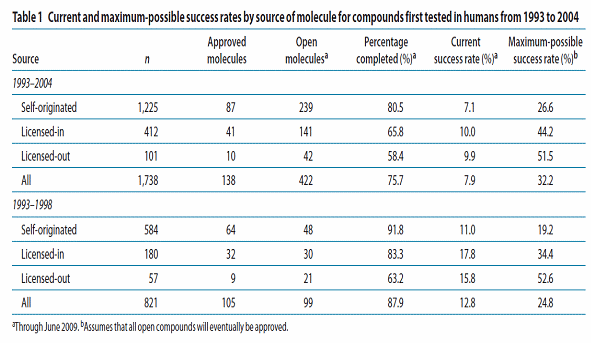
○ 둘째, 세계 의약산업계에 일반화되어 있는 폐쇄적, 방어적 목적의 지재권 전략 수정의 필요성이다. 대부분의 의약기업들은 특허권 보호 및 시장독점권을 통해 장기간의 독점적 수익을 추구하는 비즈니스 모델을 가진다. 이러한 제약산업에 있어서 가장 강력한 경쟁력의 핵심은 지재권이라고 할 수 있으며, 비즈니스 모델의 특성상 지재권 전략의 핵심은 방어장벽을 형성하는 것에 집중되어 있다. 이로인해 글로벌 제약기업의 외부 특허이전 비율이 지극히 낮은 비율을 보이는데 반해 벤처기업의 외부 특허이전은 상대적으로 높은 양상을 가지게 되는 것이다. 이와 관련된 최근의 연구결과를 살펴보면, 2002년 35% 내외에 머물던 기술 아웃소싱의 비율이 2007년도에는 55% 내외에 달하고 있으며, 특히 임상 3상까지 진입한 신약 중 63%가 외부로부터의 아웃소싱을 통해 개발된 제품들로 확인되고 있다. 또한 1993-2004년까지 임상시험에 진입한 약품 4,000개 중에서 모든 정보가 제공된 1,738개의 약품을 조사비교한 결과 자체 개발제품이 1,225개이며 거대제약사로부터 아웃라이센싱된 제품은 101개, 그리고 외부 기업으로부터 라이센스인 된 제품은 412개로 확인되었다. 또한 98년부터 04년까지 진행된 아웃소싱 흐름은 라이센스 인이 180개에서 230개로 증가한 반면 라이센스 아웃은 57개에서 46개로 9개가 줄어들었다. 또한 라이센스 인 된 제품의 성공률은 27%인 반면에 자체개발은 16%로 라이센스인 된 제품의 성공률이 상대적으로 높은 것으로 나타났다. 이는 라이센스인 된 후보물질이 가지는 자체의 독창성도 있겠으나 보다 중요하게는 라이센스인 되는 과정에서 객관적이고 치밀한 모니터링 프로세스를 거쳤기 때문일 것으로 파악된다. 이는 대개의 라이센스인 된 제품들이 개발 초기 단계가 아니라 성공 가능성이 어느 정도 확인된 임상 1상이나 2상에서 라이센스인 되었기 때문으로 추정된다.
○ 셋째, 치료제 개발과 관련하여 수십만개의 잠재적 타겟이 존재하는데 반해 인간의 질환에 대해서는 그 효과가 입증되지 않은 상태에서 어떤 개별기업이나 연구기관이 그 광대한 가능성을 검증하기란 불가능하다. 따라서 외부와의 협력, 개방형 비즈니스는 선택이 아니라 필수가 되어가고 있다. 이에 반해 의약기업의 수익모델은 거의 전적으로 지재권에 기초하고 있는데, 그렇다면 독점적 지재권 확보와 개방적 비즈니스라는 두가지 긴장을 조화롭게 만들 수 있느냐가 성공의 관건이 될 수밖에 없다. 이에 대한 해법으로 공적연구와 사적연구의 단계구분을 하고 공적연구는 초기단계에 집중하는 방식을 생각할 수 있는데, 과거의 경험을 보면 이러한 역할구분이 결과적으로 미치는 영향은 거의 없었다. 특히 최근에는 고위험 프로젝트의 경우 상호경쟁하는 기업들조차 후기단계에서의 상호협력을 추진하는 경우가 많다. 이와 관련하여 미국의 경우는 임상검증과 관련된 기술이자 동시에 발굴-개발단계의 간극을 메워줄 수 있는 중개의학 분야에 기관-기업간 협력 프로젝트를 역점 추진하고 있는데, 바이오마커이니셔티브(http://www.biomarkersconsortium.org) 그리고 유럽의 Innovative medicines Initiative (http://www.imi.europa.eu)가 그것이다. 또 다른 양상은 경쟁적인 외부협력 모델의 등장인데 Wyeth와 스코틀랜드 NIH가 협력한 Translational Medicine Research Collaboration이 그것이다. 이 모델은 대학과의 협력을 통해 그 연구성과를 와이어스가 독점하는 형태로 진행되는데 외부자원의 적극적 활용을 통한 생산성 강화 시도의 일환이라고 할 수 있다. 또 다른 방법은 머크나 노바티스와 같이 펀드를 활용한 후보물질의 확보 혹은 공동연구 방식이다(http://www.tmrc.co.uk)
○ 넷째, 글로벌 차원의 개방형 혁신, 개방형 비즈니스 모델이 활발하게 진행되는 글로벌 시대 의약산업 경쟁력의 핵심은 다양한 전문가의 경쟁력을 하나의 단일한 그룹으로 통합, 공조를 할 수 있게 만드는 힘이다. 또한 이러한 모델은 더 나아가서는 단일선형적 관리모델에서 병렬-순환적 모델을 넘어 개방형 모델에 기반한 Virtual Firm 모델로 발전하고 있기도 하다. Virtual Firm 모델은 산학협력 죠인트벤처 모델을 통해 처음 등장했으나 최근에는 글로벌 제약기업의 스핀오프를 통해 만들어지거나 혹은 임상-생명정보의 지식관리에 특화된 벤처기업들이 개방형으로 비즈니스 모델로 전환하는 방식을 통해 확산되고 있다. 글로벌 오픈이노베이션을 위한 조건들은, 1. 생산성과 과학적 영향에 대한 판단과 평가, 2. 해당분야에 대한 지식, 3. 좋은 연구, 4. 연구디자인, 5. 중개의학적 마인드셋, 6. 벤처펀드와 산업 그리고 소규모 벤처기업의 연계, 7. 효율적인 개발설계, 8. 도전과제에 대응하는 비판적 사고, 9. 프로토콜 개발, 10. 소통역량, 11. 네트워킹, 12. 개발 및 보호를 위한 전문가 접근성, 13. 지재권에 대한 중요성과 전략수립, 14. 펀딩소스, 15. 규제 및 필요조건에 대한 지식, 16. 수익/비용에 대한 평가 등이 있다. 이러한 역량은 국제적 수준에서 필요한 지식과 정보를 확보해야 하며, 개별 프로세스가 아니라 전체적인 프로세스 및 대안적 전략의 가능성 등을 고려하는 방식으로 이루어져야 한다.
○ 특히 Model Based Drug Development와 Integrated Projects Team에 관한 문제가 가장 중요한 과제인데, MBDD는 질병의 메카니즘에 대한 개념적 정의와 약물치료와 관찰된 효과간의 상관관계를 분석하는 방식으로서 질병의 상태, 관련된 바이오마커, 전임상 및 임상연구의 결과 등을 종합적으로 분석하여 안정성과 효력에 관련된 결정변수를 분석하는 것이다. 이와 관련된 실제사례로는 CPI가 있는데, 현재까지 실제 적용결과를 보면 생산성 향상 효과가 어느 정도는 있었지만, 크게 나타나지는 않은 것으로 드러났다. 이와 관련된 내용을 보다 구체적으로 살펴보면, 낮은 생산성 향상의 원인은 어플리케이션 혹은 상용화를 전제한 전체 개발과정의 리버스 엔지니어링을 실행하는 MBDD가 아니라 약물개발과 관련된 단계별로 구획된 시뮬레이션 차원에서 적용되는 방식의 한계 때문으로 지적하고 있다. 대개 단절된 M&S방식을 사용할 경우 임상 2상이나 3상에서 예기치 않은 결과에 직면할 수 있고, 이렇게 될 경우 전체 프로세스의 재설계를 요구하는 경우가 종종 나타날 수 있다. 이러한 문제와 관련하여 특히 시스템생물학적 경로분석과 경로의 네가티브-포지티브 효과, 그리고 통계확률적 필터링 등을 통해 상호작용 메카니즘을 설계, 선별하는 방식을 사용할 수 있다. 특히 임상시험 결과의 데이터베이스화는 매우 중요한 데이터로 활용될 수 있으며, 최근 미국 FDA에서 새롭게 개발되는 모든 신약은 임상시험을 진행하기 위해서는 관련된 약물의 메카니즘이나 임상진행과 관련된 정보의 공개 및 공유를 의무화하기로 했다(Grasela, T.H. et al. 2007; Dahl, S.G. et al, 2010; Krishna, R., Schaefer, H.G. & Bjerrum, O.J., 2007; Wehling, M., 2009; David, E., Tramontin, T. & Zemmel, R. 등)
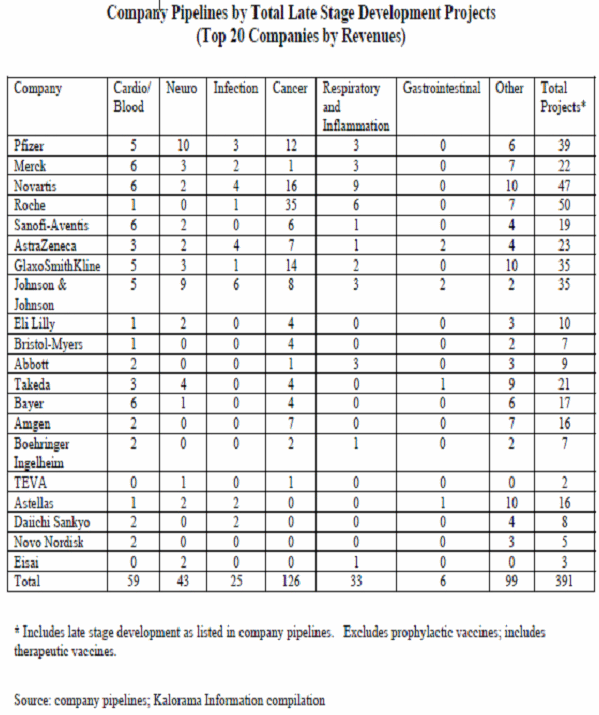
4. 항체의약품 개발동향 및 시장전망
항체의약 시장현황 분석
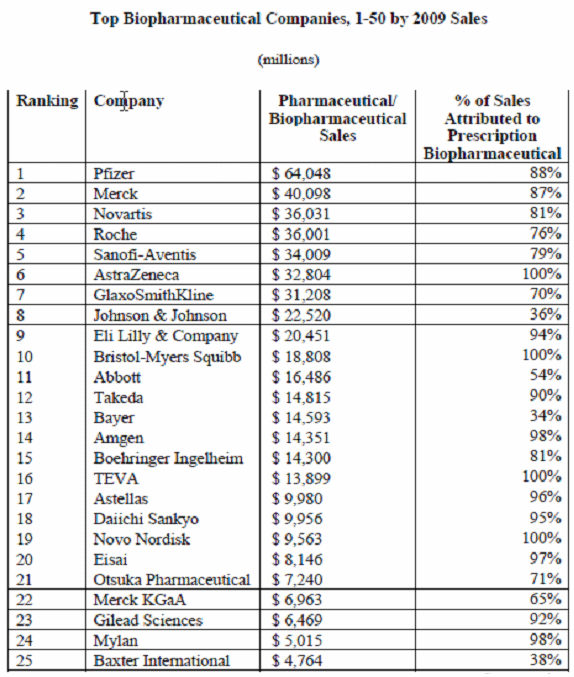
○ 항체의약은 시장에서 판매되는 200여개 바이오의약품 중 가장 빠르게 성장하고 있는 분야로서 2007년 현재 27개 항체의약품에 대한 FDA 판매승인이 이루어져 있으며 전체 전문의약품 시장 6천억 달러 중 990억 달러가 바이오의약품으로서 380억 달러는 항체신약이, 나머지 단백질 치료제가 610억 달러를 구성하고 있다. 항체신약은 미국 시장에서만 126억 달러 규모의 시장을 형성하고 있으며, 높은 제품가격으로 인해 전세계적으로 수천만명의 종양 및 염증질환 환자들의 높은 잠재적 수요를 충족하지 못하고 있어, 앞으로도 상당 기간 동안 고성장을 이어갈 것으로 전망되고 있다.
바이오의약품 년도별 매출액 변동추이
○ 항체신약은 1990년대의 단백질 의약을 이어 2000년대 바이오의약산업의 주력제품으로 떠올랐으며 2010년 현재 2세대 항체신약의 출시가 이미 시작되고 있다. 2010년 현재 임상에 들어있는 항체신약의 숫자는 200여개이며 전임상 단계에 들어있는 항체의약은 600여개에 달한다 (보고서 38 page 참조). 항체는 주로 암, 자가면역질환, 염증질환, 감염성 질환에 사용되고 있으며 기술적 성숙도가 일정 수준을 넘어서 항체신약의 임상성공율은 평균적으로 약 25% 수준에 이르는 것으로 집계되어 있다.
○ 특히 임상성공율의 경우 인간화 항체와 완전 인간항체간에 상당한 차이가 존재하는데, 항체신약의 가장 핵심적인 문제점 중 하나인 면역거부반응 조절과 관련되어 인간화 기술이 중요한데, 지금까지의 임상진행 결과에 따르면 인간화 항체의 임상성공율이 평균 17% 정도인데 반해서 완전인간항체의 경우는 25%-30%를 넘을 것으로 추정되고 있다. 완전인간항체의 경우 임상에 소요되는 기간이 대략 6년 내외라는 점을 감안하면 현재 임상 후기단계에 들어있는 완전인간항체 제품의 성공률을 최소 60-70%로 계산한다 해도 30%는 훨씬 넘을 것으로 예상된다. (2상에서 3상으로의 이행, 3상의 성공적 완료 비율이 80%를 넘는다는 점을 고려해서 계산, 항체 관련 플랫폼 기술에 따른 임상성공율 상세비교는 Development trends for human monoclonal antibody therapeutics, Review of Drug Discovery, 2010, Oct를 참조)
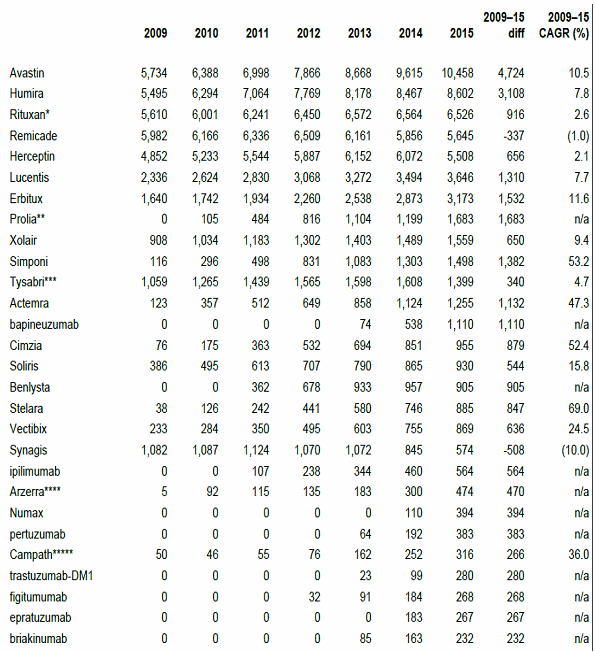
○ 항체시장의 최고 성장률을 보였던 기간은 2004-2006년으로 약 40% 이상의 년평균 성장률을 보였으나 이후에는 빠르게 감소해서 약 15% 내외를 기록하고 있고, 2009년 이후에는 10% 이하로 떨어졌다. 2003-2009년 사이 평균성장률은 29.7%로 2009년에 총 360억 달러 규모를 달성했으며, 그 중에서도 어바스틴이 57억, 휴미라가 52억, 레미케이드가 39억, 허셉틴은 37억, 리툭산은 30억 달러로 나타나서 Big 5를 구성하고 있다. 2015년에는 항체의약 시장의 규모는 626억 달러로 성장해서 연평균 성장율 9.5%로 추정되고 있다.
항체의약품의 년평균 성장률 변화추이
차세대 항체제품 전망
○ 차세대 블록버스터급 항체로는 암젠의 Prolia (16억 달러), J&J과 화이저의 Bapineuzumab (11억 달러), GSK의 Benlystark (9억 달러)로 추정되고 있으며 최근 임상승인을 얻은 제품들은 대개 완전인간항체 기술을 기반으로 단편항체 기술이 결합하거나 Conjugation 항체, 혹은 복수의 타겟에 작용하는 bispecific 항체 등이며 대개 1상 133개, 2상 132개, 3상 30개로 집계되고 있다. 차세대 블록버스터로 예상되는 주요 임상 파이프라인 제품의 또 다른 특징으로는 지금까지 종양이나 염증 중심의 항체의약이 CNS 계열로 확장되는 양상을 보여주고 있으며 항체신약의 전형적인 문제점으로 지적되는 면역거부반응, 낮은 열안정성, 낮은 세포투과성 등의 한계를 극복하기 위한 스카폴드 대체 등이 시도되고 있다는 점이다.
주력제품별 향후 경쟁제품 예상
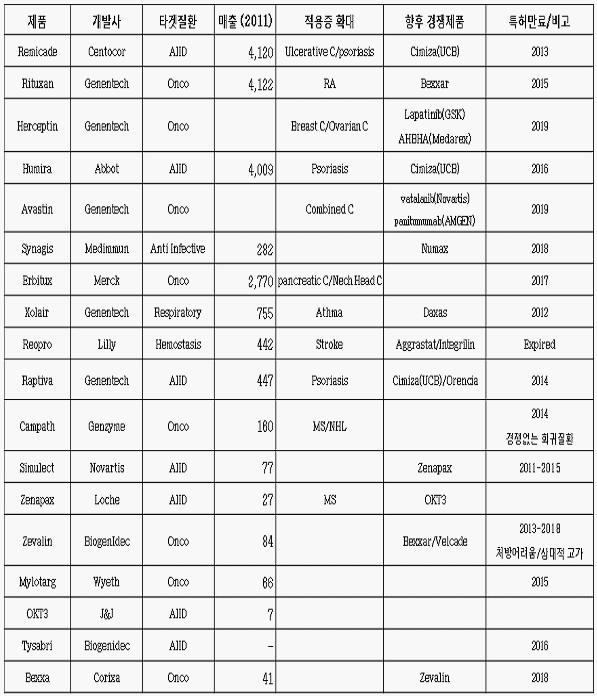
○ 차세대 항체의약품의 향후 전망을 살펴보자. 가장 대표적인게 암젠의 Prolia인데, 이 제품은 2010년 6월에 유럽과 미국에서 거의 동시에 시판승인을 얻은 제품으로 폐경이후 여성의 osteoporosis 질환 치료제로 승인되었다. 해당 시장은 성숙시장이기는 하지만 7.8억 달러 규모 시장 창출 가능할 것으로 예상되며 동일한 제품이 암 치료제로 승인될 가능성이 높아 총 16억 달러 규모 매출 발생할 것으로 예상되고 있다. Simponi는 Centocor와 쉐링플러프사에 의해 개발된 제품으로 레미케이드 시밀러 버전이라고 할 수 있다. 하지만 2009년 미국 FDA의 승인을 얻은 심포니는 레미케이드와는 달리 완전인간항체 제품으로서 면역거부반응이나 용법에서 레미케이드보다 우월하다고 간주되고 있으며 특히 자가치료가 가능하다는 장점이 있다. 이러한 장점에 기대어 심포니는 2015년 약 13억 달러 정도의 매출을 올릴 것으로 기대되고 있는데 J&J와 머크사가 센터코어와 쉐링플러프를 인수했기 때문에 자사의 레미케이드를 심포니로 대체하는 효과를 가지게 될 것이다(심포니 뿐만 아니라 휴미라, 시미자, 바이오시밀러 버젼 등이 기존 레미케이드 시장을 분점하는 양상을 보여주게 될 것) 악테메라의 경우 로슈사의 류마티스관절염 치료제로 2015년 12억 달러 매출 예상되고 있고, 리툭산을 대체할 것으로 기대되고 있다.
임상 파이프라인에 들어있는 신제품 기술특성 비교
○ 또한 종양 및 염증 치료제로 개발되었던 항체 치료제의 기존 패턴에 변화를 가져올 것으로 기대되는 것이 J&J과 화이저사에 의해 개발되고 있는 알츠하이머 완전인간화 항체인 치료제 bapineuzumab이다. 이 치료제는 타겟환자군이 매우 특정하게 한정되는 특성이 있음에도 불구하고 2015년 약 11억 달러 매출이 예상되고 있다. 또 다른 신규 치료제인 Benlysta는 GSK와 Human Genome Science가 공동개발하고 있는데, CNS계열 질환에 대한 임상결과가 매우 좋게 나타나면서 2015년 9억 달러 매출이 예상된다. 이러한 신제품 출시를 포함해서 2015년까지 항체시장의 강자를 순서대로 나열하면, 로슈, 제넨텍, 아보트, J&J, Novartis, Merck, Amgen, Chugai, BMS등이 있다.
차세대 항체의약품을 포함한 제품별 중기 시장전망
○ 차세대 항체의약품 파이프라인을 분석해보면 2012-2013년 60개에서 45개 정도의 항체의약품이 시장에서 경쟁할 것으로 예상되고 있다. 이를 기존의 임상성공율을 토대로 향후 시장에 출시될 제품의 개수를 추정해보면 다음과 같다. 현재 임상 3상 진입한 항체가 30개인데, 통상적인 임상3상 성공률 75%를 대입하면 최소 53개 이상이 시장에 존재하게 될 것으로 예측할 수 잇다. 또한 임상 1-2상에 진입한 항체의약품은 총 140개이며, 2상 84개중 2->3상 성공률인 62%를 대입하면 임상 3상 진입은 50개로 추정될 수 있다. 임상 1상 58개중 2상 진입율 62%를 대입하면 22개가 임상 2상에 진입하게 되고, 따라서 2013년부터 2018년에는 추가적으로 1상 22개, 2상 50개 등 총 72개가 임상 3상으로 진입할 것으로 예상될 수 있다. 이 중에서 75%인 54개가 추가적으로 시장에 출시될 것으로 예상되어 2018년 기준 총 135개의 항체의약이 시장에서 경쟁할 것으로 예상된다. 이러한 숫자는 현재 27개 제품의 5배에 달하는 많은 숫자이며, 그만큼 경쟁이 치열하게 전개될 것임을 예고하고 있는 것이며, 항체시장의 시장점유율 성장률 역시 지금보다 더 큰 수준으로 감소할 것은 분명해 보인다.
항체신약 이후, 바이오의약품 3세대
○ 여기에서 항체의약이 시장에 처음으로 출시된 1987년 이후 평균성장율 40%로 최고점에 오른 2004년을 간략하게 조망해보면 몇 가지 재미있는 시사점을 도출해 볼 수 있다. 1987년 처음으로 개발된 제품이 면역거부 반응 등으로 인해 시장에서 성공하지 못한 것을 계기로 항체의약 개발 전략은 근본적인 한계가 있다는 점에 대해 광범위한 공감이 일어났고, 이에 따라 전세계 대부분의 기업체들은 몇몇 대학과 벤처기업을 제외하고는 항체의약으로부터 관심을 거두어버렸다. 그러나 대부분의 사람들이 면역거부반응으로 인해 항체의약은 거의 불가능한 과제라고 믿었음에도 불구하고 정확히 10년 후 제넨텍은 1997년에 Chimeric 리툭산을 출시하는데 성공했다. 면역원성 문제에 대한 기술적 콘트롤이 가능하다는 사실이 제품을 통해 입증된 것이다. 그 이후 2006년 까지는 항체의약의 전성기를 경험했으며 2003년에는 완전인간항체인 휴미라가 출시되었고 2006년에는 최초의 단편항체 제품이 출시되었다. 최초의 항체의약 출시로부터 성장의 고점을 기록한 시기까지 약 16년이 걸린 셈이다.
○ 이러한 트렌드를 앞으로의 10년에 대해 투영해보면 다음과 같은 추론도 가능할 것이다. 항체관련 기술의 현재 성장률이 10% 이내이며 단편항체, 컨쥬게이션, 스카폴드 대체 등 다양한 변형기술 활발하게 연구되고 있으나 항체의약의 Efficacy나 Side effect와 관련된 부정적인 효과를 충분하게 컨트롤하지 못하고 있으며, 항체의약의 효과를 전체적으로 평균해 보았을 때 수명연장 효과가 높은 제품가격에도 불구하고 약 1년 내외라는 점을 고려한다면 지금까지와는 전혀 다른 새로운 접근법을 요구받을 가능성이 매우 높다. 가령 치료백신이나 줄기세포, 혹은 RNA 치료제 등이 항체를 대신한 새로운 성장동력으로 떠오를 수 있다는 것이다. 이러한 필요는 이미 영국의 NICE 프로그램을 통해서, 혹은 바이오시밀러의 진입으로 인해 기존 기업들에게 와해성 혁신에 대한 필요성이 점점 강화되는 것을 통해서 보다 분명하고 현실적인 압력으로 작용하고 있는 것이다. 특히 2010년 6월에 시판승인이 이루어진 최초의 치료용백신 Provenge이나 비록 시판승인을 얻는데 실패했으나 2009년도에 임상3상까지 진입했던 3개의 RNA 치료제 등은 1987년의 OrthoClone OKT3보다는 좋은 출발점을 보여주고 있는 것이다. 최초의 출시제품으로부터 시장성장 최고점에 도달하는데 16년이 걸린다는 점과 통상 제품개발로부터 출시까지 10년 정도가 걸린다는 점을 고려한다면 항체 이후 차세대 바이오의약 제품개발을 준비하기 위한 전략적 선택이 적어도 몇 년전에는 이미 이루어졌어야 함을 보여준다. 더구나 바이오의약 기술의 진보속도가 과거 20년전과는 비교도 할 수 없을만큼 빠르게 진행된다는 점을 고려하면 더욱 그렇다.
항체신약 기술개발 현황
○ 항체시장의 고성장, 경쟁제품의 시장진입이 점점 많아짐에 따라 모든 제약사들은 안정성 마진이 높은 약, 강력한 Epitope를 통한 높은 약효, 높은 어피티니, Fc의 높은 기능성, 더 장기의 반감기, 세포내에서의 관통력과 분산성, 그리고 약 안정성과 수용성, 효과적인 폴딩 등을 중심으로 기술경쟁에 나서고 있으며, 이러한 문제의 해결책으로 Fc 엔지니어링, glycosylation, 일관성있는 제품을 생산할 수 있는 세포배양기술, 의약생산의 포뮬레이션 등에 대해 관심을 집중하고 있다. 특히 면역원성은 완전 인간항체라 할지라도 10% 이상의 제품의 경우 중화항체의 생성으로 인해 약효감소에 직면할 가능성이 있으며, 긴 반감기의 경우 치료를 멈춰도 몇 주 정도는 체내에 작용을 할 가능성이 있다는 점, 그리고 AntiDrug Antibody가 생성되어 항체를 격퇴시킬 가능성이 있다는 점 등이 고려되어야 한다.
○ 항체 관련 기술개발시 고려해야 할 전략적 변수로는 다음과 같은 것들이 고려될 수 있다. ① 안전성과 효과성에 있어서 보다 높은 마진율을 보이는 제품개발, ② 전달경로나 처방의 용이성, ③ 세포간 전달 혹은 세포막 관통력, ④ FC 정교화를 통한 생물학적 반응 조절, ⑤ Affinity 제고, ⑥ Cell Surface 타겟에 대해서 효과성을 결정하는 Epitope의 차별화, ⑦ 다목적성을 갖는 분자포맷으로 안정성과 생산성이 높은 포맷개발, ⑧ 바이오디스트리뷰션과 티슈관통력에 관련된 사이트, 형태, ⑨ 안정적이고 효율적인 폴딩을 통해 수용성, 집중도, 집합특성, degradation 등과 관련된 분자행태의 설계
○ 항체 관련 신약개발은 4가지 유형으로 나뉘어지는데 사용되는 기술의 와해성 정도에 따라 Me Better 항체와 2세대 항체, 그리고 3, 4세대로 나눠질 수 있다. 2세대는 동일한 항원에 대해 작용하지만 Pegylation이나 Fc Fusion, Immunoconjugation등의 방식을 통해 면역원성을 저감시키거나 Affinity를 높이거나 반감기를 줄이는 방식으로 개발하는 것이며(Arzerra, Humira, Cimiza, Simponi, Mylotarg)같은 약품이 대표적이며 3세대는 다른 Epitope를 타겟팅하거나 다른 메카니즘을 작동시키는 방식으로 작용하는 약품을 의미하며 현재 2상내지 3상에 진입해 있다. (GA101; Biogen Idec/Roche/Glycart), (Synagis; MedImmune/Abbott)가 대표적인 사례로 임상 1상에 진입해 있다.
○ 항체 치료제의 경우 초기에는 면역거부반응, 높은 투약율, 고생산비용 등의 문제를 안고 있었으나 인간화 기술과 포유류 세포배양 생산기술, 그리고 회수기술의 발전에 힘입어 대표적인 바이오 의약 계열 중 하나로 떠오르게 되었다. 그 중에서도 인간화 기술은 타겟물질에 대해 결착하게 만들어주는 murine residue를 human immunoglobullin 프레임워크내로 포함시킴으로써 인간유래 이뮤노글로불린 시퀀스의 96% 이상을 달성하는 방식이다. 이렇게 인간화된 항체의약은 지속적인 약물투여가 필요한 경우에 더욱 선호되는데 이는 인간화 기술을 통해 HAMA반응(human anti mouse antibody 생산반응)을 저감시킬 수 있기 때문이다.
○ 또한 투약방식에서의 기술개발 역시 활발해지고 있는데 입원환자만이 아니라 자가 치료환자들이 항체의약을 보다 손쉽게 이용하기 위해서는 침습형 약물투약만이 아니라 피하주사나 근육내 주사 방식의 약물투여가 필요하다. 그러나 이러한 약물투여방식이 가능하기 위해서는 고농도(>100mg/mL)의 제재생산이 가능해야 하며 동시에 생산물의 안정성과 처방의 용이성이 보장되어야 한다. 또한 항체를 이용해서 타겟세포를 사멸시킬 수 있는 약효물질을 전달시키는 방식으로 작동하는 conjugated antibody 개발과 관련해서도 역시 타겟세포까지 해당 약효물질을 안전하게 전달할 수 있도록 항체안정성을 높이는 생산기술, 제형기술 등이 개발될 필요가 있다.
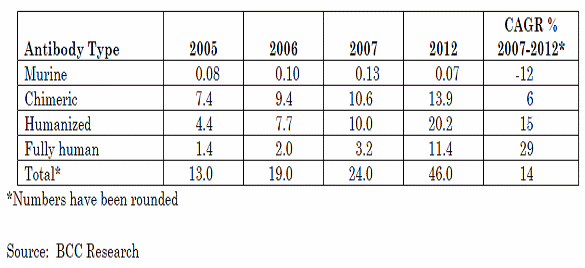
○ 항체 치료제의 경우 다양한 항원에 대한 치료제 개발이 신속하게 이루어질 수 있으며 높은 Affinity, 미세 국소작용(나노 혹은 피코미터), 많은 임상경험을 통한 확립된 기술지식 등과 관련한 장점이 있으나, 거대분자라는 점, 구조복잡성이 높다는 점, 분자구조의 거대복잡성으로 인해 포유류를 사용한 발현시스템을 요구하기에 최적화와 배양과정에서 높은 비용 및 시간을 요구한다는 단점을 가진다. 항체는 일반적으로 네가지 종류의 생산방식을 통해 만들어지는데 100% 마우스 단백질을 사용한 Murine, 65% 인간단백질, 35% 마우스단백질이 결합된 Chimeric, 95%의 인간단백질과 5%의 마우스 단백질이 결합된 Humanized, 그리고 100%인간단백질을 사용하는 방법으로 구분된다.
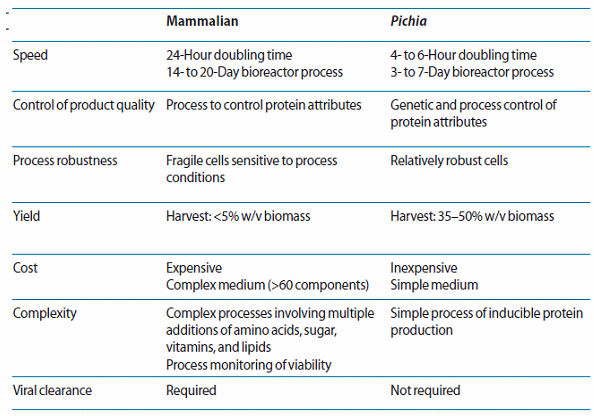
생산방법에 따른 시장점유율 변화추이
○ 완전항체는 일반적으로 포유세포를 통해서 만들어지는데 대개 Chinese hamster ovary (CHO)세포나 NS0 mouse myeloma 세포, 그리고 Hybridoma세포를 사용해서 만들어지며 최근에 PERC6 세포를 사용한 생산방법이 도입되고 있다. 최근 UCB가 개발한 Cimiza의 경우 E. Coli를 이용한 생산기술에 의해 만들어지고 있는데 CHO기반 생산기술에 비해 낮은 고정자본 투자비용, 높은 수율 등을 장점으로 갖는 대신 PTM의 필요성 증가라는 단점을 동시에 가지고 있다. 특히 CHO, NS0에 기반해 있는 현재의 생산방법은 당 관련 문제가 항상 존재하며, 이러한 점으로 인해 반감기, 면역거부, 약효력 약화 등의 문제에 직면하게 된다. 이에 따라 특히 Glyco Engineering기술이 발전하기 시작했는데 당의 구조를 변경함으로써 circulatory half-life, potency, tissue distribution, and immunogenicity 등의 문제를 해결하고자 하는 것이다. 가령 암젠의 EPO-A을 Aranesp로 변환하는 것은 당과 관련된 것이고 세레자임을 대체하는 개량신약도 당엔지니어링 기술을 활용한 것이다. 당 엔지니어링은 단지 기존 약물에 당의 구조나 구성요소를 변경하는 것만이 아니라 발현시스템의 변화도 가능하게 만들었는데 03년에 Pichia pastoris를 통해 인간세포에서 만들어지는 당단백질과 유사한 단백질을 생산하는데 성공했다. 특히 이 발현 시스템은 보다 정교한 당 엔지니어링 기술을 가능하게 만들었을뿐만 생산되는 제품의 균질성 역시 훨씬 높았다. 미생물 사용 발현 시스템이나 일회용 생산 시스템이 가져올 변화 역시 매우 높다.
생산방법의 상대비교
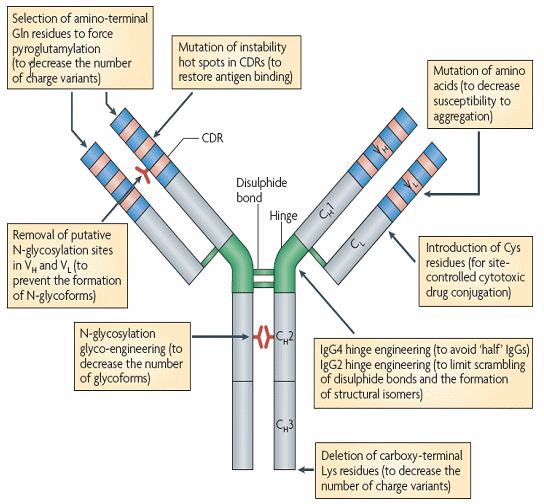
○ 이들 기술 외에도 항체관련 기술의 핵심이라고 할 수 있는 항체엔지니어링 기술과 관련해서도 인간화 기술은 매우 중요한 역할을 했는데, 특히 사이즈(size), 타겟지향성(affinity), 그리고 특정성(specificity)을 획기적으로 높여서 최적화가 가능하게 만들어주었다. 특히 항체의 경우 ADCC (antibody dependent cellular cytotoxicity), CDC (complement-dependent cytotoxicity), ADCP (antibody-dependent cellular phagocytosis)와 같은 Effector function을 유도함으로써 타겟세포의 사멸을 촉진하거나 혹은 liceptor-ligand interaction을 가로막는 방식으로 바람직하지 않은 수용성분자를 중립화 시키거나 혹은 타겟세포의 상태를 변화시킬 수 있는 특정한 신호를 전달하는 방식으로 작용하게 되는데, 이러한 원리를 이용해서 다양한 질환에 대해 효과를 가진 항체를 개발하는 항체설계 기술의 영역이 더욱 확대되거나 혹은 단일약재에 다양한 기능을 가진 Combinatory Antibody 생산 기술 역시 개발되고 있다.
○ 1세대 항체에 대해 가변도메인의 개선을 통한 면역원성의 저감방식을 활용하거나 Affinity를 높이거나 낮추는 방식, Fegylation이나 Fc Fusion에 fab을 컨쥬게이트하는 방식으로 항체포맷을 변형하는 방법, 혹은 동시에 두 개의 타겟을 공략하는 Bispecific 기술을 사용하는 2세대 항체개발이 이루어지고 있다. 이와 관련 가장 최근의 기술개발 방향은 단편항체로 모아지고 있다. 가령 단편항체는 이미징 관련 어플리케이션으로 사용될 경우 암세포 투과율이 높고 체내에서 빨리 배출되기 때문에 완전항체에 비해 커다란 장점을 가지고 있다. 또한 단편항체의 경우 그 구조가 단순하고 간단하기에 포유류를 사용한 생산방법 외에도 E.Coli를 사용한 생산이 가능하기 때문에 생산비용의 획기적 절감이 가능하다는 장점을 갖기도 한다.
○ 단편항체 관련 기술의 경우 Fv는 Affinity와 Specificity와 관련되어 있고 Fc는 면역세포와의 상호작용에 관련되어 있다. Fc는 글리코실레이션이나 ADCC 작용, 그리고 반감기 조절 등과 관련된다. 이에 반해 Fab의 경우는 단일항체의 단점을 커버하기 위해 만들어졌으나 반감기가 짧다는 문제가 있다. Cimiza의 경우는 이러한 문제를 해결하기 위해 하이드로다이나믹 볼륨을 높이기 위해 FEG Moiety를 사용하고 있다. scFv는 Fab에 비해 더 작은 단편으로 만들어졌지만 높은 세포투과성으로 인해 반감기가 짧은 문제를 극복하고도 남는 장점을 가지고 있다.
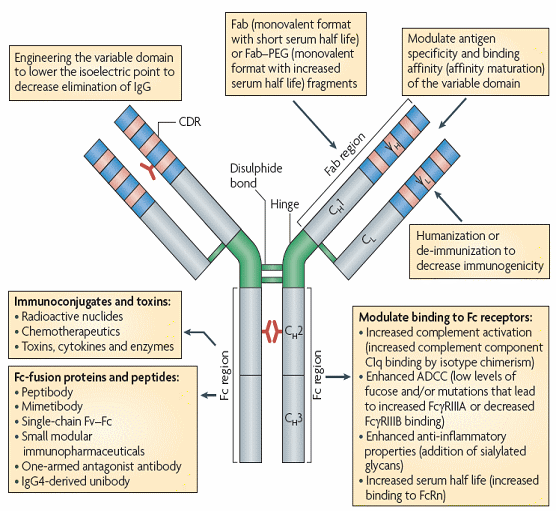
○ 2세대 항체의 또다른 접근법으로는 동일한 타겟 혹은 서로 다른 타겟을 동시에 공격하는 것으로서 이들 제품의 경우 임상이 성공할 경우 서로 다른 항체를 사용할때에 비해 효과는 높고 비용은 크게 절감된 효과를 가져다 줄 것으로 기대되고 있다. 임상2상에 진입한 복합항체는 blinatumomab (MT103; Micromet/MedImmune)이 있다. 그러나 복합항체의 경우 이질적인 이뮤노글리불린 체인의 결합에 의한 상호작용, 스케일업과 정제과정 상의 불확실성이 증가함에 따라 복합항체의 실용화에는 일정한 한계가 있을 것으로 예상되어왔다. 하지만 최근 Dual Variable Domain IgG기술을 통해 일정하게 극복되고 있다. DVD IgG는 연쇄상의 Vl두개 도메인과 경쇄상의 Vh 두 개 도메인을 결합하는 방식으로 만들어지는데 이렇게 만들어진 결합항체는 CHO 생산기술을 사용한 양산효율성 역시 입증되어 있는 상태이고 또 다른 복합항체 생산기술로는 기왕에 존재하는 항체의 가변부에 대해 추가적인 paratope를 연결하는 방식으로 HER2와 VEGFA에 동시 작용하는 기전을 가진다. 이 두 개의 기술은 양산성 역시 충분히 입증되어 있는 것으로 보고되고 있다. (Alain Beck, et al, Nature Reviews of Immunology, May, 2010). 또한 가장 최근의 기술인 scFv의 경우 멀티베리언트 바인딩이 가능해서 디아바디, 미니바디 등을 만들 수 있으며 최근에는 낙타나 상어로부터 추출한 단일도메인 항체가 개발되고 있다.
○ 3세대 항체로 분류가능한 치료타겟을 신규한 것으로 개발하는 것과 관련하여 단백질체학이나 기타 다른 방법으로 특정항원을 도출, 선별한 뒤 이에 따라 역설계를 하는 방식으로 이루어지는데 (리버스파마코놀로지 방식 사용), 4세대 제품개발의 경우 잠재적 경쟁자는 상대적으로 낮은 반면 개발 및 비지니스 위험성이 높지만 혁신적인 제품을 만들 수 있는 장점이 있다. 염증치료제의 경우 타겟메카니즘이 잘 알려져 있는 반면에 종양치료제의 경우 원인이 다차원적이고, 종종 충분한 이해가 부족한 경우가 많으며, 암치료제에 대한 내성이 발달한 환자가 많아서 치료제 개발이 상대적으로 힘들다. 이 분야의 치료제는 많은 경우 부작용 발생비율이 높고 (EGFR, VEGFA를 타겟으로 할 경우) 성장인자간의 세포신호 충돌 혹은 교란 등으로 인해 세포신호 전달 시스템에 대한 보다 정교한 이해가 필요한 분야이다. 최근 새롭게 발굴-발전된 치료타겟은 tyrosine kinase receptors in malignanciesinsulin-like growth factor 1 receptor (IGF1R)인데 2009년 현재 100여개의 임상시험 중인 제품 중 최소 9개가 이 타겟정의에 기반해서 개발되고 있는 제품들이다.
○ 종양분야의 3세대 항체기술은 종양확산을 막거나 혹은 세포사멸을 촉진하는 새로운 항체와 항원을 발굴하는 것인데, 이러한 전략은 그 작용기전이 충분히 알려져 있지 않거나 혹은 기술개발의 불확실성이 높아서 장기고투자라는 위험을 감수해야만 한다. 면역장애로 인한 질환치료제의 경우 그 원리와 타겟이 비교적 잘 연구되어 있으나 종양질환의 경우 이론적 성과가 아직은 상대적으로 취약한 상태로서 타겟선정에 어려움이 많다. 특히 암환자가 항체치료제에 대한 내성을 만들어서 암세포의 성장을 가능케하는 새로운 분자물질을 생성하는 문제가 새롭게 확인되는가 하면 암세포의 성장과 관련된 복잡한 상호작용 메카니즘에 대한 불충분한 이해 등도 기술적 장벽을 구성하고 있다.
○ 면역관련 질환은 TNF, IL-1, IL-2, IL-6R, IL-12, IL-23, RANKL, IL-4, IL-6, IL-13, IL17등에서 확인할 수 있듯이 대개 사이토카인이나 연관된 리셉터를 타겟팅하는데, Iflammatory 질환의 경우는 (질환유발 기전이 비교적 잘알려져 있기에) 신규타겟을 발굴하기보다는 기능개선에 초점이 맞추어져 있고, Oncology의 경우는 기전이 다기다양하고 그 기전에 대한 이해가 부족하기에 신규타겟발굴이 매우 어렵지만 도전할 가치가 있는 영역이다. 뿐만 아니라 암환자들의 경우 최신 치료제에 대한 내성이 키워져 암세포의 성장을 촉진하는 신규분자의 발현을 유도하는 경향이 있는데 이를 극복하는 문제 역시 중요한 과제이다. 또 다른 어려움중의 하나로는 약물과 약물타겟간의 조합을 결정하는 어렵고 복잡한 문제이다. 예를 들어 EGFR과 VEGFA를 동시처방받은 Colorectal 환자에게서 피부발진이나 어지럼증, 그리고 감영성 질병이 발생한 사례가 있다. 성장요인들간의 상호교통, 혹은 성장인자 리셉터 이형이량체간의 상호교통을 충분히 이해해야만 타겟선별이 가능해진다. 최근 온콜로지 분야의 실험적 입증 타겟으로는 IGF1R(인슐린 유사 성장인자 1 리셉터)가 있는데 IGF1R은 이미 20여년 전에 온코단백질로 알려져 있었으나 그 개발이 이루어지지 못했었는데 2009년 이후 약 100여개의 임상이 진행되고 있으며, 이들은 모두 9개의 IGF1R 특이적 iGGs을 타겟팅하고 있다.
임상 파이프라인에 들어있는 단편항체 현황
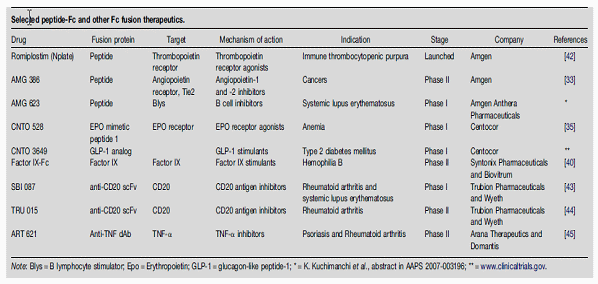
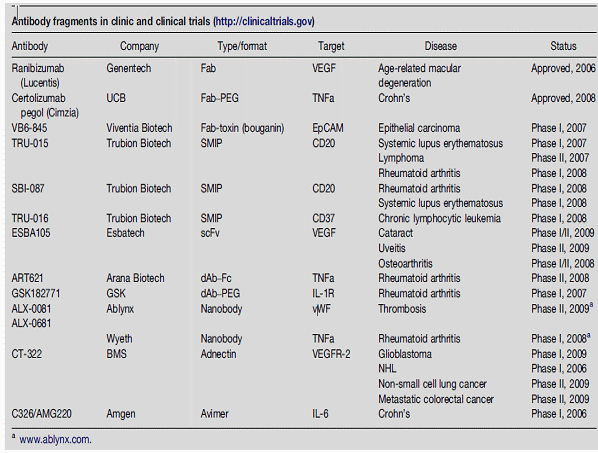
○ 또 다른 보다 급진적인 대안으로는 스카폴드의 대체가 연구개발 중인데, 그동안 항체의약품의 근본적인 문제로 지적되어 왔던 몇가지 기술적 문제점을 극복하기 위한 대안으로 기술개발이 활발하게 진행되고 있다. 항체 스카폴드란 면역혈청이 아닌 다른 특이결합 단백질을 이용한 의약개발 기술로서 아미노산의 서열을 변경하거나 추가적인 아미노산을 결합함으로써 전혀 새로운 결합특이성을 갖도록 만드는 기술을 말한다. 스카폴드 선택은 길이가 짧고 안정성이 높은 구조를 가진 것이 선택되는데 좋은 스카폴드를 선택할 경우 양산수율, 다양한 활용 가능성을 가지게 된다. 항체신약의 문제점 중에서도 대표적인 것이 세포내에 존재하는 타겟물질에 접근하기 어렵다는 점, BBB 통과의 어려움, 최적화에 필요한 시간이 길다는 점, 지식재산권의 신규성이 매우 약하다는 점, 미생물 활용 발현생산성이 상대적으로 낮다는 점, 열이나 온도에 대한 안정성이 낮고 프로테아제에 대한 내성이 없어서 오랄투약이 어렵다는 점 등이 있다. 이와 관련 항체신약의 일반적인 Ig 스카폴드 대신에 Non-Ig 스카폴드를 개발하려는 노력이 활발하게 진행되고 있는 것이다.
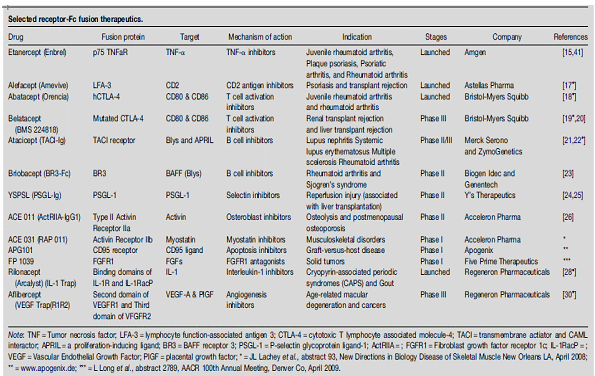
○ 지난 15년간 약 50여개의 서로 다른 스카폴드가 제안되었는데, 그중에서도 Affibodies, Monobodies, Anticalins, DARPins 등이 대표적이다. 이러한 non-IG 스카폴드의 경우 100여개 이상의 타겟을 대상으로 개발 가능한데, ADCC나 CDC 메카니즘을 활용한 치료효과가 아니라 엔자임이나 저해제와 연계하는 방식으로 이루어지고 있다. 따라서 대상질환 역시 autoimmune diseases, hormone dysfunctions, neoangiogenic pathologies를 대상으로 하며, 세포투과성이 높아서 항암치료제를 전달하기 위한 전달체로 사용되는 경우가 많다 (이와 관련된 구체적인 적용사례 및 최신 개발동향은 Engineered protein scaffolds as next-generation antibody therapeutics, Michaela Gebauer and Arne Skerra, Current Opinion in Chemical Biology 2009을 참조하면 좋다)
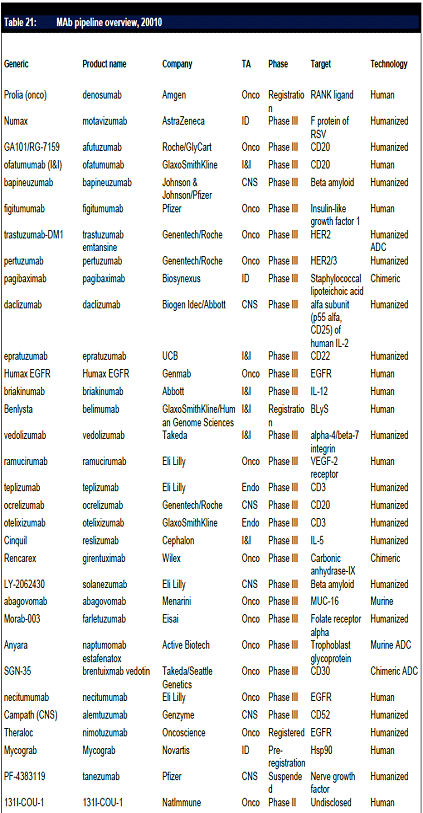
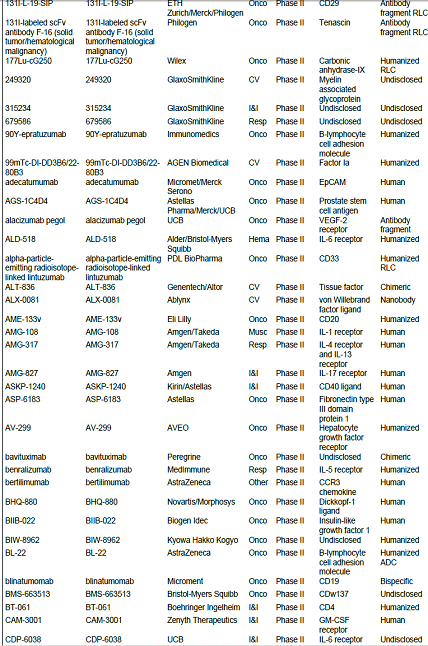
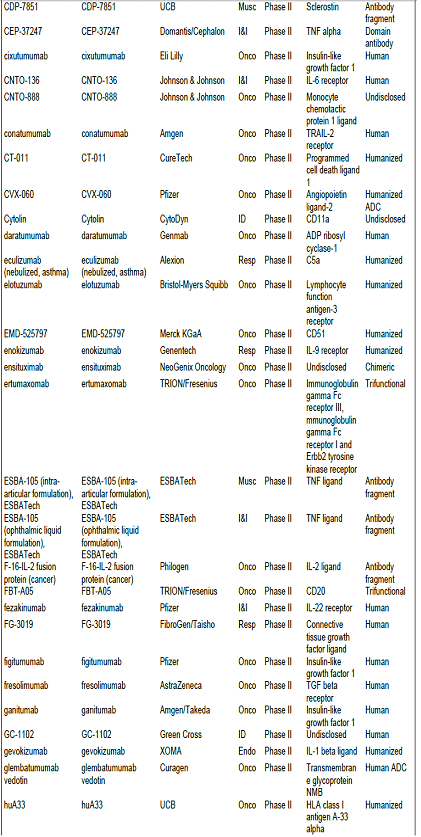
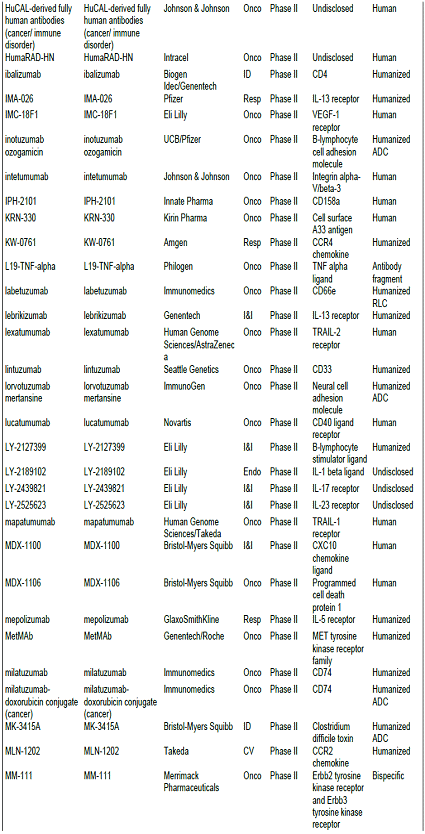
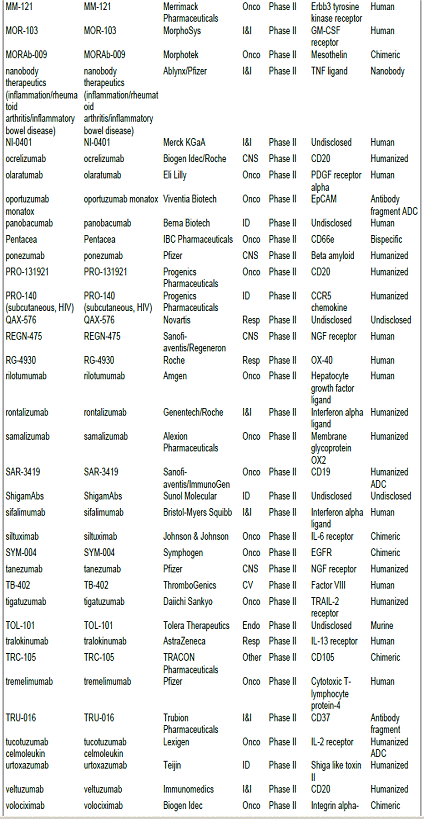
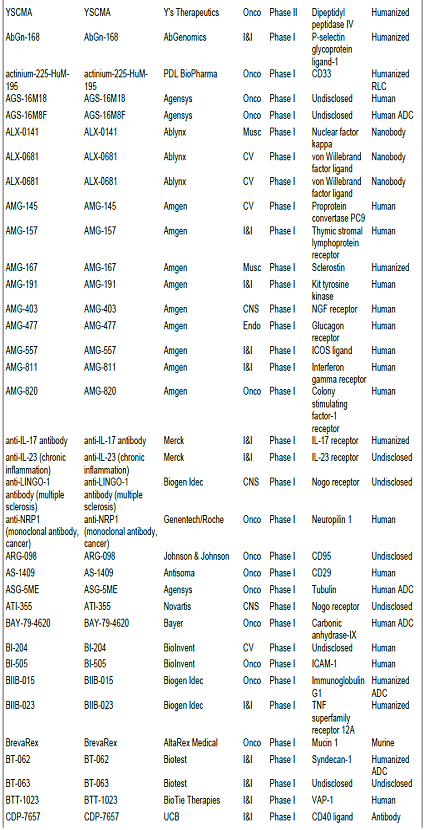
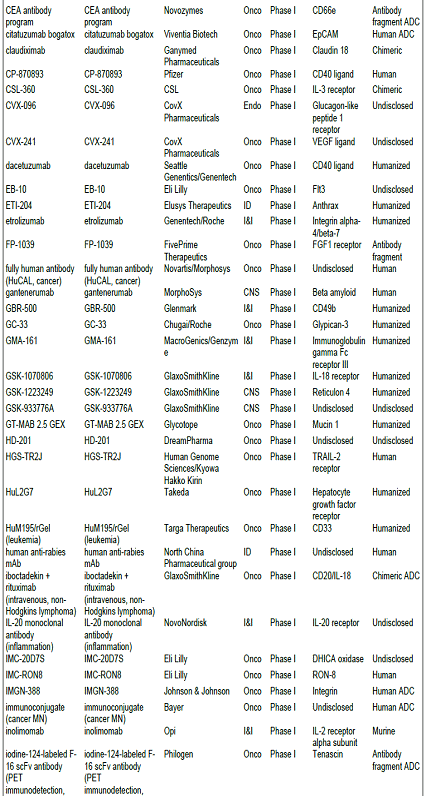
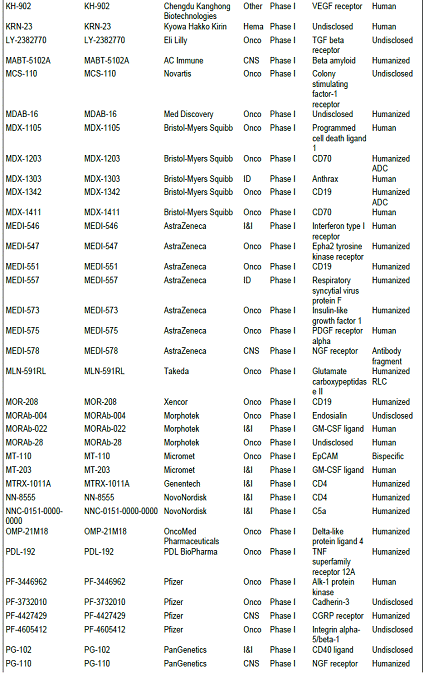
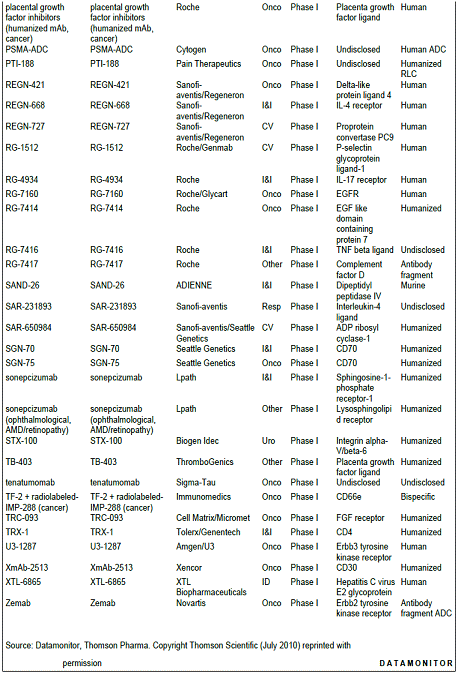
항체신약 파이프라인 현황, 2010년 기준
5. 분자진단과 맞춤형치료
분자진단의 발전방향
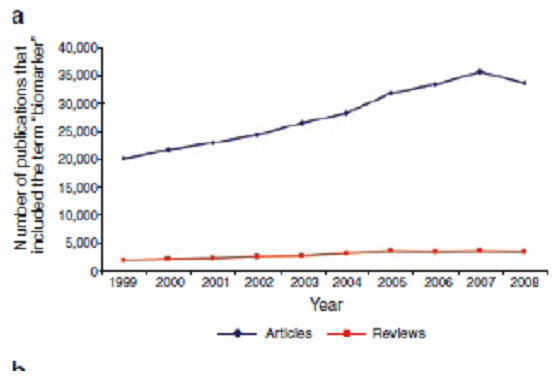
○ 분자진단이란 DNA, RNA, 단백질이나 메타볼라이트를 계측함으로써 지노타입을 포착하거나 신체상의 유전자 변이, Biochemical 변화 등을 측정하는 것으로서 오믹스 분석과 판단을 위한 기기 및 장비의 발달, 그리고 인포매틱스 기술의 발달에 힘입어 성장하고 있는 영역이다. 수요측 성장요인으로 보면, 높은 임상실패율, 낮은 개발신약의 환자적합도, 부작용을 최소화할 수 있는 맞춤형의료에 대한 수요 증가, 높은 바이오의약 가격 인하를 통한 의약가격 합리화 등 다양한 요인에 의해 성장이 촉진되고 있다.
PubMed기준, 바이오마커라는 제목의 논문 증가수
○ 맞춤형의약은 질병에 대한 치료가 아니라 환자에 대한 치료라는 컨셉으로 출발했으며 기술적 혁신의 문제라기보다는 비즈니스 모델의 문제로서 이미 개발된 의약과 진단을 통합할 수 있는 비즈니스 모델 개발 및 소비자의 참여인센티브를 개발하는 것이 중요하다. 30년전만 해도 치료는 대개 의사와 환자의 직접적인 연계 속에서 이루어졌으니 현대의 치료는 수술을 제외한다면 간접적인 방식의 대량치료를 통해 이루어지고 있다. 이러한 과거의 시스템 속에서는 환자가 자신이 필요한 것을 선택하고 그 비용을 지불하는 방식으로 작동되지만 현대의료체계에서는 보험사와 정부기관, 그리고 치료제 공급회사가 환자에게 필요한 것을 결정하고 그 비용을 지불하는 방식을 취한다. 하지만 구글헬스나 MS헬스 등이 개인별 맞춤형 의료정보를 수집, 공유, 활용하는 서비스를 제공하는 등의 방식으로 소비자들이 주체가 된 의료정보 사회네트워크가 형성되고 있는 것이 현실이다.
○ 분자진단이란 DNA, RNA, 단백질이나 메타볼라이트를 계측함으로써 지노타입을 포착하거나 신체상의 유전자 변이, Biochemical 변화 등을 측정하는 것으로서 오믹스 분석과 판단을 위한 기기 및 장비의 발달, 그리고 인포매틱스 기술의 발달에 힘입어 성장하고 있는 영역이다. 수요측 성장요인으로 보면, 높은 임상실패율, 낮은 개발신약의 환자적합도, 부작용을 최소화할 수 있는 맞춤형의료에 대한 수요 증가, 높은 바이오의약 가격 인하를 통한 의약가격 합리화 등 다양한 요인에 의해 성장이 촉진되고 있다.
○ 분자진단은 DNA, RNA, 단백질이나 메타볼라이트를 계측함으로써 지노타입을 포착하거나 신체상의 유전자 변이, Biochemical 변화 등을 측정하는 것으로서 오믹스 분석과 판단을 위한 기기 및 장비의 발달, 그리고 인포매틱스 기술의 발달에 힘입어 성장하고 있는 영역이다. 수요측 성장요인으로 보면, 높은 임상실패율, 낮은 개발신약의 환자적합도, 부작용을 최소화할 수 있는 맞춤형의료에 대한 수요 증가, 높은 바이오의약 가격 인하를 통한 의약가격 합리화 등 다양한 요인에 의해 성장이 촉진되고 있다. 그런데 분자진단이 정확한 의사결정을 위한 도구 혹은 수단이라는 점에서 가장 중요한 과제로 신뢰성과 정확성, 신속성, 편이성이 제기되고 있으며 특히 생명정보와 임상의학정보를 통합, 유용한 지식을 창출하고 이를 기기수준에서 적용하는 문제 등 아직도 많은 영역에서 상당한 수준의 기술적 발전이 요구되고 있다. 비즈니스적 측면과 관련해서는 낮은 투자관심도를 극복하는 문제, 약물개발 메이저기업에 대한 높은 의존성, Reimbursement 포함문제, 환자에 대한 직접 서비스가 가능한 다양한 비즈니스 모델 개발 등이 주요 과제로 제기되고 있다.
○ 분자진단 기술은 크게 오믹스 시퀀싱 장비 및 도구의 발전, 바이오인포매틱스 기술의 발전, 그리고 임상지식정보 Mining기술의 발전을 기반으로 하고 있으며, 이론적인 차원에서는 각종 오믹스를 포괄해서 시스템 차원의 연관관계를 분석하는 시스템생물학의 연구성과에 기반해 있다. 분자진단 기술은 진단장비 및 기기를 통한 제품화의 경로와 약물발굴 및 개발에 활용하는 방식, 그리고 환자중심의 통합적 헬스케어가 가능한 모니터링 및 처방지원 서비스 등으로 활용가능하며 더 나아가서는 예방적 차원의 식이 및 행태처방 등은 물론이고 맞춤형 미용식, 건강기능식, 약물이나 의료서비스 선택에 있어서 환자중심의 의사결정권 확대와 관련된 다양한 서비스 개발이 가능하다.
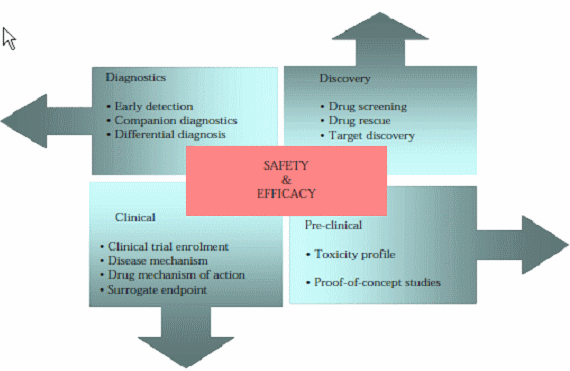
분자진단과 맞춤형의약 구성요소
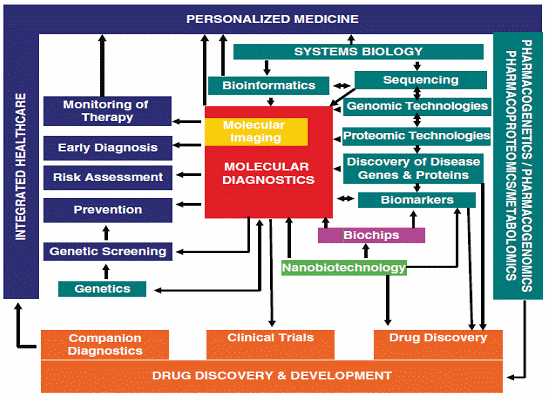
○ 분자진단 기술은 현재까지 크게 세가지 비즈니스 모델에 기초하여 발전하고 있는데, 첫째는 이미 글로벌 제약기업들 사이에 실제 적용되고 있는 것처럼 제약사를 중심으로 보다 정확한 약물설계와 약물선별을 통한 연구개발 생산성을 높이고 및 임상시험의 합리적이고 예측적인 설계를 통해 임상성공율을 높이는 한편 그 기간을 단축시킬 수 있는 효과적인 수단의 하나로 활용되고 있으며, 둘째, 현재 미국 정부가 대대적인 투자를 진행해서 병원 임상정보를 통합한 뒤 이를 기반으로 중증질환 중심의 맞춤형의료서비스 제공하려고 시도하는 것처럼 치료가 어렵고 복잡한 질환에 대하여 다양한 치료수단을 효과적으로 조합 최적의 의료서비스를 제공하기 위한 Clinical Decision Support 구성요소 중 하나로 활용되거나, 셋째, 세계적인 의료서비스 제공으로 유명한 May Clinic, 그리고 우리나라의 경우 차병원 차움 테라피에서 제공하는 것처럼 개인의 유전자 정보 분석을 통해 질환발생 가능성을 사전에 예측하고 이를 예방할 수 있는 각종 의학적 정보 식이처방, 생활행태 개선방안 등을 제공하는 개인별 맞춤형 의료서비스를 제공하는 방식으로 발전하고 있다.
○ 위와 같은 세 가지 영역의 비즈니스 모델 중에서 가장 큰 시장규모와 성장률을 보이고 있는 분야는 바이오의약산업으로서 이는 연구개발생산성, 낮은 임상성공율과 관련된 문제를 해결하는 동시에 Targeted Therapy를 통한 치료효과를 높이고 부작용을 최소화하는 타겟지향적 의약개발로 패러다임이 전환되고 있기 때문이다. 특히 차세대 바이오의약품 개발 패러다임인 치료백신, 유전자 혹은 RNAi치료제, 세포치료제 등은 모두 효과적인 개발을 위해 적합한 바이오마커를 활용하는 것이 필수적이며, 그 기술적 특징으로 인해 환자맞춤형 치료제 개발이 대세를 형성할 것으로 예상된다. 다시말해 바이오의약산업 분야에서 분자진단은 단기적으로도 그 수요가 명확하며 중장기적으로도 분자진단이 의약개발의 필수적인 구성요소로 자리잡게 될 것이라는 점에서 지속적인 성장성이 매우 높은 분야이다.
분자진단 세계시장 전망

○ 분자진단 시장은 전세계적으로 약 500여개 기업이 진입해 있으며, 시장지배자인 9개의 세계적 대기업 Roche, Chiron, Gen-Probe, Abbott, Digene, Bayer, Myriad Genetics, Becton Dickinson, and bioMerieux가 전체 시장의 75%를 장악하고 있다. 중요한 니치시장의 플레이어들로는 Agendia, Bio-Rad, Biosite Diagnostics, Cepheid, Chembio Diagnostic Systems, Chiron (Novartis), Ciphergen Biosystems, Correlogic Systems, Cytyc, DiagnoSwiss, Diagnostic Products, Digene, DiaSorin, Epigenomics, EXACT Sciences, Gen-Probe, Genaissance Pharmaceuticals, HandyLab, Innogenetics, Interleukin Genetics, Matritech, Myriad Genetics, Nanogen, Nuvelo, Nymox Pharmaceutical, OXIS International, Proteome Sciences, Sequenom, SomaLogic, Sysmex, and Third Wave Technologies 등이 있다. 주요 제품으로는 FDA의 승인을 얻은 Affymetrix사의 GeneChip System 3000Dx, Roche사의 AmpliChip CYP450, Tm Bioscience사의 Tag-It, 그리고 Osmetech사의 eSensor 등이 있다. 현재로서는 대부분의 분자진단이 특별한 연구소를 중심으로 이루어지고 있으나 앞으로 관련기술이 진보함에 따라 대부분의 연구소에서 이루어질 것으로 기대되고 있으며 POC 영역으로의 진출 역시 가속화 될 것이다.
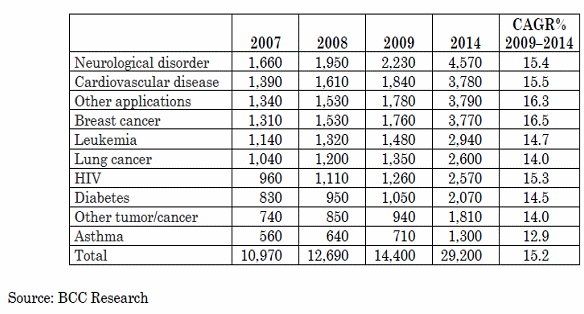
분자진단 영역별 시장규모 (백만달러)
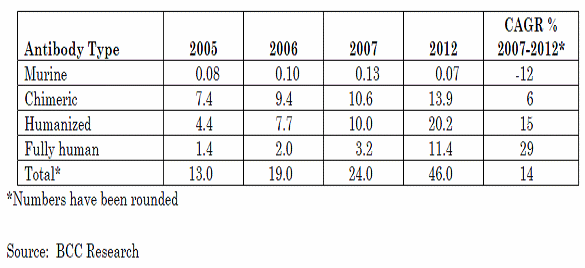
○ 위의 표는 BCC Research에서 분자진단 분야의 시장을 세분화하여 2007년부터 2014년까지의 성장률을 예측, 시장규모를 추정한 결과인데, 바이오의약 및 진단기기 분야의 성장률이 16.8%로 가장 높은 것으로 나타난 반면에 헬스케어센터 분야는 13.5%로 상대적으로 낮게 추정되어 있고 시장규모 역시 다른 분야의 시장규모보다 작은 것으로 나타나있다. 하지만 세계적인 트렌드는 이미 맞춤형 의약을 넘어선 맞춤형 의료로의 패러다임 전환을 요구하고 있기에 헬스케어 분야에서 분자진단의 역할과 중요성, 특히 분자진단과 임상의학정보를 연계한 지식정보 서비스의 역할이 더욱 강하게 나타날 것으로 예상된다. 이와 관련, 분자진단 분야의 시장전망을 위해 2009년에 세계 250여개 기업체 설문조사 결과에 의하면 2-3년 이내의 단기 시장성장성과 관련한 전망으로 종양질환, 염질환, 유전자분석, 약동력학 분야가 각각 33, 30, 14, 12%를 차지한 반면, 중장기 예측에서는 종양, 약동력학, 감염성질환, 유전자 분석이 각각 34, 26, 14, 12%를 차지해서 약동력학 분야가 장기적 성장분야로 인식되고 있음을 확인할 수 있었다(Molecular Diagnostics: Promises and Possibilities, Mousumi Debnath et al, Segments of Molecular Diagnostics Market Place, 2010, Springer)
Companion Drug/Diagnostics
○ 미국의 의료비용은 2005년 1.3조 달러에서 2009년 2.6조 달러로 상승했으나 신약개발 생산성은 점진적으로 저하하고 있으며 높은 의료비용에도 불구하고 환자가 체감하는 의료서비스 품질은 오히려 낮아지고 있다. 이로 인해 Personalized Medicine, Personalized Therapy, Integrative Healthcare에 대한 사회적 요구가 점점 증가하고 있으며 이와 관련된 정부의 연구개발 지원 역시 급격하게 증가하고 있다. 2010년 통과된 오바마 의료개혁법안은 이러한 여러가지 문제들을 해결하기 위한 일종의 종합적 개혁대안이면서 동시에 환자중심의 통합적 헬스케어시스템으로 전환하기 위한 조치라고 할 수 있다.
○ 맞춤형의약 및 의료에 대한 사회적 수요는 그동안 보건의료 관련 지속적인 정부투자와 바이오의약산업의 발전에도 불구하고 환자의 건강한 삶과 사회적 질환부담 개선이 기대한만큼 나아지지 않았다는 사실에 기인한다. 특히 질환치료 후 5년 이상 생존율은 전체적으로 1970년대 50%에서 2009년 66%로 증가하는데 그쳤을 뿐이며, 1996-2004년까지의 통계를 통해 Division of Cancer Control and Population Sciences가 2008년에 발표한 자료에 따르면 암 질환 중 Non-hodgkin Lymphoma, Melanoma, Unirary Bladder, Colerectal, Breast, Prostate등은 생존율이 50% 이상으로 비교적 높은 편이지만 Pancreatic, Lung 등은 생존율 2% 내지 20%에 불과한 것으로 나타났다.
○ 또한 미국내 병원 입원환자의 5.3%가 약물부작용으로 인한 환자이며 1994년 기준 매년 10만명 이상이 약물 부작용으로 사망하는 것으로 나타났다. 현재 사용되는 치료제 중 항우울증은 38%, 아스마는 40%, 당뇨병은 43%, 관절염은 50%, 알츠하이머는 70%, 암은 75%가 약리효과가 없는 것으로 조사되었으며, 치료효과가 높은 바이오의약품의 경우에도 평균적인 치료효과는 50% 내외에 불과한 것으로 조사되었다. (Clinical Trends in Molecular Medicine, Brian B. Spear et al, Volume 7, Issue 5, 1 May 2001). 특히 미국에서 약물부작용으로 인해 고통받는 환자는 매년 20만명이며, 그 비용만도 250억 달러에 달한다. 이와 관련 로슈의 앰플리칩을 사용하게 될 경우 로슈의 주장에 따르면 부작용발생 가능성을 44% 로 줄일 수 있으며, 비용으로 환산하면 2020년 약 210억 달러 절감이 가능하다고 한다.
○ 지금까지 알려진 바로는 개인별 유전자 변이가 약리효과의 20-95%를 결정한다고 한다. 특히 Genetic Polymorphism 이 약리효과나 독성과 관련한 차이를 발생시키는 주요 원인으로 지적되고 있는데, 이를 이용해서 약물 대사과정과 약리효과를 연구하거나 혹은 유전자적으로 발생하는 부작용의 정도나 확률을 예측하고 임상설계를 합리화하는 방식이 파마코지노믹스, 파마코제네틱스라는 이름으로 집중연구되고 있다. 특히 이들 연구결과는 타겟팅해야 할 처방환자의 정밀한 분류와 처방용량 및 처방약 선정과 관련한 임상적 판단에 많은 도움을 준다는 장점을 가진다(진단기기동반 의약개발).
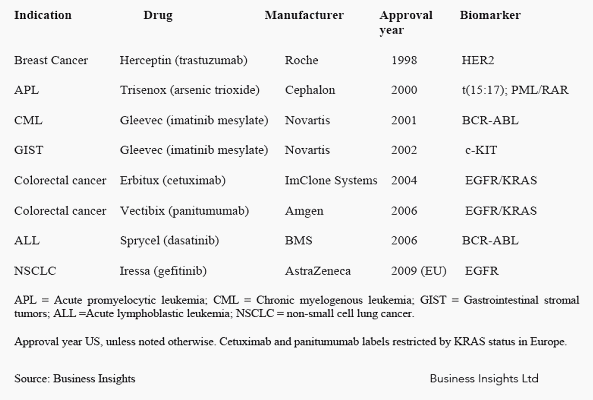
○ 진단기기 동반형 신약개발과 관련한 대표적인 사례로는 다음과 같은 사례들이 열거될 수 있다. 글리벡을 처방을 받아야 할 만성적 Myelogenous Leukaemia 환자에 대해 31개의 유전자에 대한 바이오마커를 대상으로 진단할 경우 94%의 정확도를 가지고 약리효과 반응이 있을 환자와 그렇지 않은 환자를 구분할 수 있다는 임상시험 결과가 제출되어 있으며, 잘 알려진 허셉틴의 경우 약리효과 반응이 있는 환자의 비율이 20-30%에 불과한데, HER2의 과발현을 검증하는 방식으로 대상환자군을 정확하게 분별할 수 있다. 또한 China Medical Technologies는 2009년 11월 leukemia BCR/ABL fusion gene를 측정하는 방식으로 chronic myeloid leukemia, acute lymphoblastic leukemia, 그리고 acute myeloid leukemia을 진단할 수 있는 진단기 키트 개발, 시판승인을 획득한 것으로 알려지고 있다.
○ EGFR (epidermal growth factor receptor)를 타겟팅하는 약물로 Vectibix와 Erbitux가 있는데, 이들과 관련된 동반 진단기기가 FDA 승인을 신청중에 있다. 이를 통해 치료대상 환자를 특정할 경우 6억 달러가 절감 가능하며 OncotypeDx를 사용할 경우 약물부작용의 사전제거로 인해 환자당 1930달러를 절감할 수 있을 것으로 보고된 사례가 있다(Genomic Health Web site. Economic Validity,2009) 또 다른 사례로는 2009년 11월 Ionian Technologies Inc와 Roche Diagnostics Corp이 isothermal 신속 핵산 증폭기술에 기반한 진단기기 공동개발에 관한 협약을 체결했으며, Sequenom Inc과 Optherion Inc는 age-related macular degeneration (AMD) 징후를 예측할 수 있는 진단기의 상용화 개발에 관한 라이센싱을 부여했다.
○ 분자진단의 경우 감염성질환에서 가장 발달해 있으며 그 다음이 Oncology로 향후 5년간 고속성장이 예상되고 있는데 진단분야의 사업에 소요되는 투자비용은 총 1백만에서 10백만 달러, 소요기간은 3년에서 5년으로 정도로 추정된다. 분자진단 시장이 아직은 충분히 성장하지 않은 상태이며 뒤에서 살펴보겠지만 기술적 해결과제가 아직도 많이 남아 있는 분야라는 점으로 인해 분자진단 관련 벤처기업이 시장에서 생존하기에는 여러 가지 어려움을 겪을 수밖에 없다. 물론 의약개발에 비해 비교적 짧은 개발기간과 적은 자본투자로 시장진입이 가능하지만 수요자의 대부분이 거대 제약사이거나 거대병원이기에 환자들에 대한 직접적인 서비스를 제공하는 비즈니스 모델이 정착되기 이전까지는 수요자 독점 시장의 특성을 가지게 되는 것이 가장 큰 문제라고 할 수 있다.
○ 특히 분자진단 관련기업들이 선택하는 비즈니스 전략의 대부분이 글로벌 제약기업과의 공동개발, 제휴 등을 통해 진단기기 동반 신약개발을 선택하게 되는데 이는 분자진단 시장을 성장시키는 가장 강력한 추동력이 의약개발 생산성 향상에 대한 요구로부터 나온다는 점에서 불가피한 것이기는 하지만, 분자진단 벤처기업으로서는 많은 위험을 감수해야만 하는 선택이기도 하다. “동반”이라는 사실 자체가 분자진단 전문 벤처기업의 전략적 선택범위를 제한하게 만들기도 하지만 더욱 위험한 것은 동반의 대상이 되는 약물의 임상성공 여부에 따라 진단기기의 운명이 결정된다는 점이다. 이와 관련 최근에 진단기기 분야의 전통적 강자였던 Loche가 분자진단 전문기업인 Ventana Medical System, NimbleGen, 454 Life Science 등을 인수하면서 진단기기와 약물개발을 통합적으로 추진하고 있는데, Risk&Resource Control이라는 관점에서 대기업-벤처기업 연계협력 모델에 비해 보다 효과적인 전략이라고 판단된다. 로벌 제약기업이 분자진단 전문기업을 인수합병한 또다른 사례로는 Abott사가 KOS Pharmaceutical를 인수한 것, BMS사가 XDx라는 진단전문기업을 인수한 사례가 있다.
맞춤형의약 개발과 분자진단

○ 분자진단을 활용한 진단기기와 약물의 동반개발 전략이 한 축으로 진행되고 있으나 분자진단 기술의 진정한 가치는 블록버스터형 패러다임으로부터 맞춤형 의약개발이 지배하는 멀티버스터, 니치버스터형 패러다임으로 이행하는 전환점을 제공해준다는 측면에서 더욱 주목될 필요가 있다. 지금까지의 치료제 개발은 다수의 환자를 포괄하는 블록버스터형 타겟질환을 선정한 뒤 통계적 확률에 의존해서 약물선별, 임상시험을 진행하는 방식이라고 할 수 있다. 이에 반해 향후 도래할 지배적 패러다임은 분자적 수준에서 질환의 원인과 메카니즘을 밝히고 약물에 대한 반응 양상을 분류함으로써 보다 정확한 약물설계, 타겟질환군을 정의하는 방식이라고 할 수 있다.
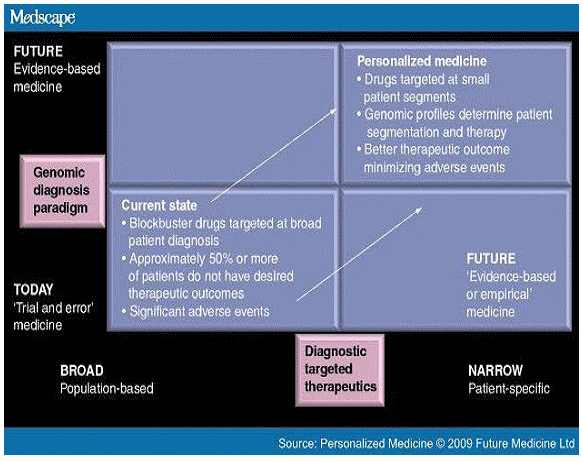
○ 분자진단을 활용한 맞춤형의약 개발은 개발된 치료제를 다른 질환에 대해 적용하는 Drug Repositioning, 용량과 용법을 환자의 특성에 맞춰 처방하는 것, 약물 부작용을 회피하는 것, 약물개발 프로세스를 시간적으로 단축하는 것, 약물개발에 소요되는 비용을 절감하는 것, 임상시험에 필요한 과정과 절차를 합리화하는 것, 타겟환자 그룹에 대한 정밀한 정의를 통해 임상환자 모집에 따른 비용과 시간을 절감하는 것, Surrogate End Point 설정, 이를 통해 조기에 프로젝트의 계속 추진여부를 판단하는 전략적 의사결정, 그리고 질환의 메카니즘에 대해 보다 정확하고 체계적으로 이해하는 것 등이 있다. 현재 글로벌 의약기업들이 적용하고 있는 분자진단 기술은 대개 약물개발과 임상시험 과정에서 비용을 절감하고 기간을 단축시키며, 동시에 임상성공율을 높이는 방향에서 활용되고 있으며, 또 다른 한편으로는 기존의 블록버스터 약물을 다른 질환에 적용하기 위한 멀티버스터 전략의 일환으로 추진되고 있다.
블록버스터모델과 맞춤형의약(멀티버스터)모델의 비교
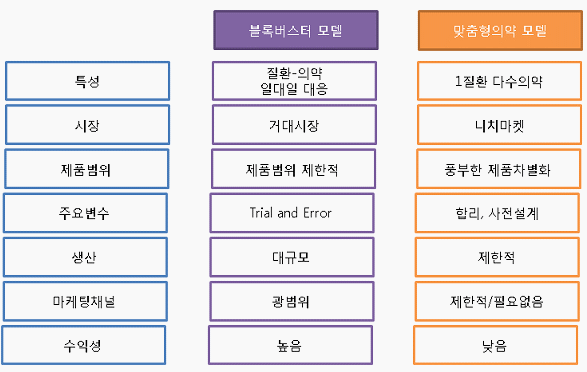
○ 바이오의약품 개발에서 제품시판까지 소요되는 기간은 대략 10년이며 임상통과율은 20% 이내이고 전체 신약개발 비용 13억 달러 중 39.7%가 전임상 이전, 43.9%가 임상1-3상에서 발생하며 판매 및 등록비용으로 6.4%가 지출되는 것으로 분석되고 있다. 또한 1975-1999년 사이에 승인된 548개의 신약 중 56개가 마케팅 이후에 부작용을 나타내어 퇴출이 되었는데 이들 제품을 조기에 중단시킬 수 있었다면 엄청난 비용을 절감할 수 있을 것이다. 특히 전임상 이전에 임상진행 여부를 보다 정확하게 판별하거나 혹은 임상시험 프로세스 설계의 합리화를 통해 전임상 이후 승인율을 40% 수준으로 올릴 수만 있더라도 신약개발 비용의 20-30% 이상, 개발기간 2-3년 단축이 가능해 질 수 있다(J.A. Wagner, Strategic approach to fit-for-purpose biomarkers in drug development, Annu. Rev. Pharmacol. Toxicol. 48 (2008) 631?651). 실제로 Chronic Myelogenous Luekaemia의 경우 글리벡에 대한 환자의 반응성 진단을 위해 31개의 바이오마커를 사용해서 약효반응성을 추정한 결과 임상 3상에서 약 94%, 2상에서 71%의 정확도를 나타내는 것으로 파악되었다.
○ 맞춤형의약은 의약개발 비용 감소, 의약지출비용의 절감, 적은 영업망, 오판드럭법을 활용한 시장점유기간 확대 등의 장점을 가진다. 현재의 기술발전 수준을 감안하여 맞춤형 의약을 타겟티드 의약으로 정의할 경우 임상 2상과 3상에 진입한 약물 중 타겟티드 의약은 지난 2001년 15% 내외에서 2010년 70% 수준으로 증가했다. 이 중에서 대표적인 약품으로는 Warfarin, Erbitux, Gleevec, Vectibix, Sprycel, Iressa, Herceptin, Plavix등이 있다.
맞춤형의약개발 대표적 사례
바이오마커를 활용한 임상시험 증가추이(2005-2009)
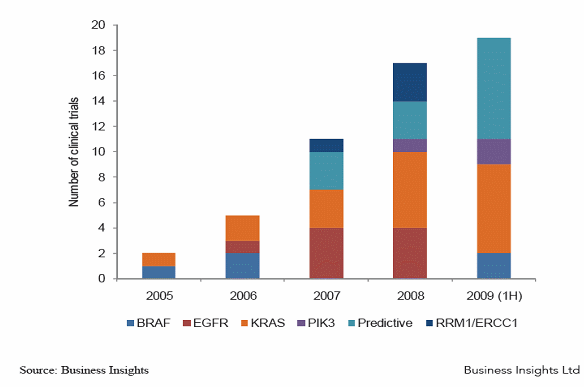
○ 위의 그림을 통해서 알 수 있듯이 분자진단을 활용한 의약품 개발 전략은 2007년 이후 빠르게 성장해서 현재는 거의 대부분의 글로벌제약기업들이 분자진단 전문기업과의 공동개발, 연구협력을 체결하고 있는 것으로 파악된다. 그 중에서도 대표적인 사례를 든다면, Mayo 클리릭 연구소가 유방암 환자의 분류를 통해 맞춤형 진단과 치료기술 개발하고 있고, 영국의 Physiomics는 Eli Lilly와 암세포의 진행 프로세스를 시뮬레이션하는 방법으로 세포분열 과정을 타겟팅하는 약물개발을 진행하고 있고 Nanostring Technology는 워싱턴대학의 유전자분석센터와 함께 당뇨병 관련 유전자의 발현을 검증하는 방법을 개발하고 있으며, Odyssey Thera는 화이저와 살아있는 인간세포에 대해 약물대사와 관련된 생물학적 작용에 대해 분석하는 기술을 개발해서 약효 및 부작용 여부를 검증하는 기술을 개발하여 활용하고 있다. UCB Pharma는 Entelos와 협력하여 류마티스 관절염에 대한 약효와 부작용, 투여량 결정과 관련된 사항을 컴퓨터상에서 시뮬레이션 함으로써 임상설계에 응용하는 기술을 개발, 활용하고 있다. Ingenuity Systems는 FDA와 함께 자폐증, 알츠하이머, 당뇨, Chron병, 여러 가지 암과 관련된 바이오마커 개발을 통해 임상시험에서 조기에 독성을 검증할 수 있는 기술을 개발하고 있다.
질환별 맞춤형의약 시장(백만달러)
○ 이외에도 ABbot는 PX Biovision, Iconix, 독성 및 질환관련 ?타이드와 단백질 발굴하는데 집중하고 있으며, Astrazeneca는 Epistem Plc, Cell Signalling Technology, BG Medicine, Caprion, PX Biovision, Iconix, Monogram Bioscience등과 함께 독성평가 및 타겟약물 발굴에 활용하기 위해 유전자, 단백질 기반 기술을 활용하는데 집중하고 있다. Bayer Healthcare는 Caprion, Oxford Biomarker Service, Vermillion등과 함께 유방암 조기진단 및 임상설계에 활용하고 있으며, BMS사는 Epitome, Immunicon, XDx Inc 임상설계 및 타겟약물 선별하는데 주력하고 있다. Elli LLily 역시 HistoRx, Iconix, Immunetrics, Molecular Staging, PPD등과 함께 임상설계를 위한 바이오마커 발굴, 약물검색 등에 활용하고 있고, GSK는 Aclara Biosciences, Bg Medicine, Lipomics technologies, Phenomenome Discoverties, VirtualScopics, Zyomyx등과 함께 약물반응, 질환 메카니즘에 따른 바이오마커 발굴, 약물의 대사경로와 약효검증, 약물결합 진단기를 개발하고 있다.
바이오마커 기반 전문기업(2009년 기준)
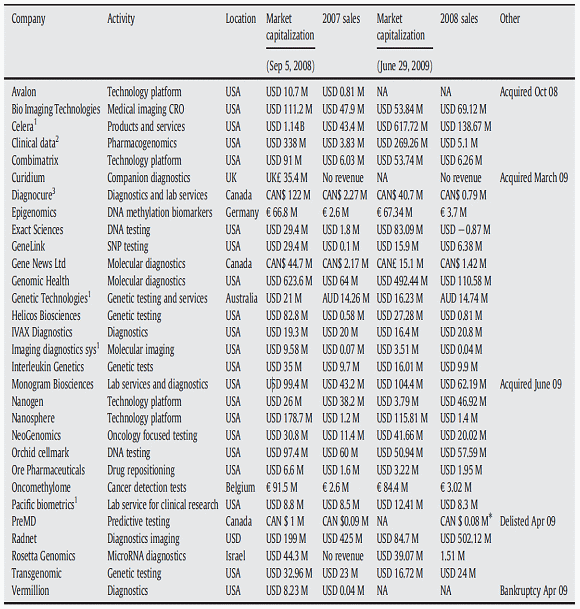
○ J&J는 Caprion, Cell Signalling Technologies, GenoGo Inc, Gene Network Science등과 함께 약물검색 및 다양한 바이오마커 발굴을 위해 협력하고 있으며, Merck는 PX Bioscience, Foxhollow Pharmacogenomics, GeneGo Inc, Monogram Biosciences, Phenomenome Discoveries 등과 함께 환자의 질환진행 모니터링 및 임상설계를 위한 타겟환자군 선별, 그리고 대사체학을 활용한 그 내용이 공개되지 않은 어플리케이션 연구를 수행하고 있다. Novartis는 BG Medicine, Parallele Bioscience, Protea Biosciences, ChondroGene, Vermillion등과 함께 유전자, 단백질 바이오마커를 활용한 질환진단 및 약물검색에 나서고 있으며 Pfizer는 Caprion, Entelos, Genestruct, Oxford Glycoscience, Phenomenome Discoveries, Vermillion등과 함께 다양한 분야에서 바이오마커기술 활용하고 있다. SanofiAventis 역시 Caprion, Cell Signalling Technologies, Vermillion등과 함께 단백질 기반 바이오마커를 활용한 전임상, 1, 2상 약효검증에 주력하고 있다.
분자진단 장비 및 분석시장
○ 분자진단 장비 및 분석시장은 세계적으로 30억 달러의 시장을 형성하고 있으며 년평균 성장률은 13%로, 유전자 분석기, 단백질 분석기, 메타볼로믹 분석기, 휴대형 진단기 등 장비 및 도구산업을 중심으로 발전하고 있다. 대표적인 기업으로는 Symx, Accelrys, Tripos, Agilent, DNAstar, Compugen(인스라엘), Optribrium(영국), StrandGenomics(인도)등이 있으며 이들 기업의 년평균 매출액은 8천만 달러 내외이다.
분자진단 장비 및 도구시장
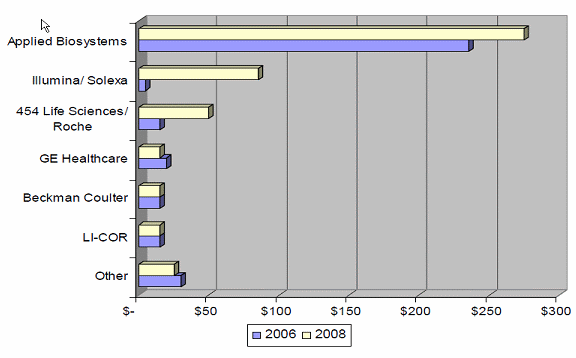
○ 분자진단 장비 및 기기기술은 1980년대 이후 지속적으로 성장해 왔으며 최근에는 완전인간 유전체 분석에 소요되는 비용은 1만 달러 수준까지 하락하는 등 기술적 성숙도가 상대적으로 매우 높은편 (2000년 기준 완전인간유전체 분석비용은 5억 달러)이다. 유전자 검사비용은 500달러 내외이나 시간이 지남에 따라 감소할 것으로 예상. 한 예로 인간 유전자 전체에 대한 분석비용은 2015년에 1천 달러로 내려갈 것으로 예상되고 있으며, 의사들은 이 기술을 이용해서 환자의 질환이나 생물정보를 이용한 치료법, 질환예방 등에 관한 처방이 가능해 질 것이다. 현재는 개인당 35만 달러의 비용이 청구되고 있으며 Life technologies사의 경우 신기술 개발에 따라 환자당 1만 달러 서비스 제공이 가능할 것으로 예상하고 있다. 2010년 현재 Illumina는 환자당 19,000달러에 지놈시퀀싱 서비스를 제공하고 있는데 이는 2004년부터 2008년 사이에 유전자 분석비용이 년간 약 10배 이상씩 절감되고 있는 것과 같다. 또한 분석속도 역시 빠르게 증가하고 있는데 Complete Genomics의 경우 2009년에 2만명, 2013년에 백만명을 분석할 수 있을 것으로 예상되고 있다. 특히 2007년 이후 생명정보 생산을 위한 도구 및 장비시장의 경우 대기업간 흡수합병(Symx와 Accelrys사간의 합병)등이 진행되면서 독점적 시장경쟁 구조로 진입할 것으로 예상된다. 이에 따라 전통적인 도구 및 장비 개발 및 판패를 주력으로 한 비즈니스 모델에서 Schrodinger와 Simulation Plus의 통합정보처리시스템 개발에서 볼 수 있듯이 통합적 분석서비스 패키지 시스템 개발 등 지식관리-지식생산 분야로 이동 중으로 파악된다.
○ 분자진단 장비 및 기기관련 시장을 좀 더 세분화하면, 신규 약물타겟을 발굴하거나 약물 안정성과 효능을 검증하기 위해 유전자 시퀀싱, 제노타이핑, 유전자 발현과 관련된 데이터를 분석하는 지노믹스 시장과 단백질체학을 기반으로 신규약물타겟, 바이오마커 발굴을 통한 진단 및 약효평가에 주로 사용하는 프로테오믹스 시장, 그리고 시스템 차원에서 분자간의 상호작용을 규명하는 방식으로 약물의 대사작용, 약리효과 모니터링, 질환메카니즘 분석등에 관련된 메타볼로믹스 등으로 나눌 수 있다. 지노믹스 분야에서 대표적인 기업으로는 Affimetrix, Applied Biosystems, Agilent Technologies등이 있으며, 프로테오믹스 분야에서는 Agilent Tech, Applied Biosystems, Biowisdom, Bruker Daltonics, Geneva Bioinformatics, Genelogics, Health Discovery Corp, Vermillion등이 있다. 메타볼로믹스 분야에서는 Ariadne genomics, GeneGo, Ingenuity Systems, BG Medicine, Cellnomica, Compugen, Curagen, Entolos, Genstruct, Genomatirx 등을 비롯한 12개 기업이 있다.
분자진단 서비스 시장
○ 분자진단 서비스 시장의 총 규모는 50억 달러 내외로 추정되며 유전자 발현분석시장(2006년 11억 달러에서 2012년 24억 달러로 성장), SNP분석시장(2007년 6억2천만 달러에서 2012년 22억 달러로 성장), 메타볼로믹스 시장은 최근 급성장하는 분야로 전체 오믹스 100개 기업 중 5개 이내가 메타볼로믹스 시장에 진출한 것으로 파악된다. 이와 관련 대표적인 기업으로는 Accelrys, StrandGenomics, Genomic Solution, BlueGene, Agilent techs, Prosarix등이 있다. 특히 Quest Diagnostics는 임상진단 및 분석서비스로 08년 66억 달러 매출을 올렸으며, LabCorp는 임상진단에 주력하는 기업으로 08년 매출 4억 달러를 달성했고, Genzyme사는 효소기반 의약기업으로 희귀질환에 특화되어 있는데, 이를 기반으로 진단시장으로 진출, 08년 총 42억 달러 매출액 중 진단서비스 부문에서만 3억2천만 달러 달성했다. 또한 Bio-Reference Laboratories는 분석시장에 전문화되어 있으며 08년 매출 3억 달러를 달성했으며 Genomic Health, Inc는 유전자기반 암 분석에 특화된 기업으로 08년 1억 달러 매출을 달성했다.
○ 분자진단 서비스와 관련된 정보관리 및 유통기술 분야의 경우 기존 IT업체가 참여하거나 IT업체와의 연계협력을 통해 발전하는 경우가 일반적이며 인도의 Infosys, MindTree, Tata등이 세계적 플레이어로 활동 중에 있는데, DataMining, Knowledge Discovery 기술과 관련하여 AI(인공지능), 소프트웨어 설계 기술 등에 특화된 벤처기업이 지식생산 시장으로 진출하고 있으며 이들은 대개 비즈니스 전략개발, 컨설팅 서비스 등을 통합한 패키지형 서비스 제공을 새로운 비즈니스 모델로 설정하고 있다.
○ 의약개발 아웃소싱 시장은 2010년 96억 달러로 성장률 15%를 기록하여 2015년에 167억 달러로 성장 예상하고 있는데, 이 분야의 대표적인 기업으로는 Argenta Discovery, Albany Molecular, BioDuro, Inc. Caliper Life Sciences, Charles River Labs, Covance, Inc, ChemBridge GenScript, Evotec, Inc. Jubilant Biosys, Ligand Pharma, Chemsys Pharmaron, Ricerca Biosciences, Shanghai Medicilon, WuXi AppTec 등이 있다.
○ 연구실기반 임상연구 서비스 시장은 약물중독, 임신진단, 유전질환 분석, 독성검사나 면역검사 등을 대행하는 분야로서 2009년 527억 달러에서 2015년 650억 달러로 성장 전망되고 있으며 이에 따른 년편균 성장률은 5%로 추정된다. 대표적 기업으로는 Quest Diagnostics and Laboratory, Corporation of America가 대표적인데 이들 기업의 매출액 합계는 120억 달러에 달하고 잇으며 주요 수요자층은 공공의료보험기관(50%), 민간보험회사(35%), 특수진료기관(20%), 개인환자(2%) 등으로 분석되고 있다. 특히 Bio Reference Lab, Genomic Health Inc, Genzymes 등은 특정질환, 특정 분석영역에 전문화된 기업으로 년매출은 평균 1-3억 달러 내외 수준으로 분석되고 있다.
○ 분자진단 정보와 임상의학 지식정보를 연계 통합한 서비스 제공이 이루어지는 맞춤형의료시장은 현재까지 시장규모를 추정하고 잇지 못한데, 그 사업내용은 대개 의약개발 프로세스 설계, 예측기반 임상시험 설계, 헬스리스크평가분석, 인터넷 기반 환자관리 서비스 시스템, 텔레헬스를 위한 전문가 기반 의사결정 시스템 구축 및 서비스 등 다양하고 광범위하게 분포하고 있다. 대표적 기업인 McKesson Corp의 경우 통합정보 시스템 및 솔루션 개발로 년매출 50억 달러 달성하고 있으며 임상시험 설계 및 컨설팅을 제공하는 PhaseFoward는 년매출 1억 7천만 달러의 매출액 기록하고 있고, 바이오인포매틱스와 임상의학정보를 통합하기 위한 지식관리 및 생산 시스템의 핵심적 구성요소인 온톨로지 분야의 경우 Gene Ontologies, OBO, SNOMED, BioPAX, MeSh등이 대표적인 기업이며, 생성된 온톨로지는 Googel Medicine, WIkiproteins, BioWiki등을 통해 공유되고 보다 전문적인 지식정보 수집 및 가공은 Technorati, Delicious 등을 통해 추가 가공되어 대중에 대한 서비스를 제공되고 있다. 분자진단 및 임상지식정보 소프트웨어는 ABrevity, Accelrys, Agilent Tech, Biowisdom, CambridgeSoft, Elesvier MDL, Geospiza, GeneLogics, IO Informatics, KOOPrime, LabVantage, NextBio, Oracle등에 의해 개발되고 있으며 임상 및 메타볼로믹 연구결과를 수집분석하고 이를 구조화시키기 위한 마이닝 및 서칭 툴을 제공하는 회사로는 QUOSA, Lingumatics, Inforsense, Insightful, Nervana, Velocity등이 있고, Cytel, Axio Research, Phoenix Data Sytem, Clinphone등이 화이저, 노바티스, 밀레니엄파마등에 대해 공급, 서비스 중이다.
○ 임상의학지식정보를 기반으로 한 맞춤형의료 지식정보 서비스 시장은 의사나 인턴에게 임상관련 정보 실시간 제공, PDA를 통한 임상의약정보 제공, 약물 및 질환에 관한 백과사전적 정보제공, 임상관련 정보제공을 통한 의사의 처방결정 지원 등을 수행하는 서비스로서 해당 시장의 연평균 성장률은 12% 내외이나 기업당 수익률은 100%를 넘는 초고속, 고성장 산업분야이다. 대표적인 기업체로는 AccessMedicine Mcgrawhill (의사나 인턴에게 임상관련 정보 즉시 제공 2천7백만 달러), Clin-eguide and Mobile Clin-eguide Kluwer (PDA에 증거기반 의약임상정보 제공4억9천만 달러), Clinical Xpert Thomson Reuter (약물, 약물작용, 질환, 대체의약 등 정보제공), Micromedex Thomson Reuter (매출액 3억9천만 달러), Epocrates Online Epocrates (8천8백만 달러), Evidence-Based Medicine Guidelines Wiley (응급치료에 필요한 임상정보 제공, 진단/처방/증거관련 자료 제공 1억 9천만 달러 매출), MDConsult Reed Elsevier (임상관련 정보 제공을 통해 치료를 위한 의사결정 지원 1천5백만 의사에 서비스 제공 08년 8억1천만 달러 매출) 등이 있다.
분자진단 기술적 과제
○ 맞춤형의약을 위한 정보분석 및 장비와 기기는 과거에는 HTS를 비롯한 다양한 기기 및 정보분석에 힘입어 발전했으며 이제는 각종 오믹스의 발달과 시스템생물학, 그리고 지식정보 디스커버리 기술의 발전, 임상정보와 유전자 정보의 통합적 이해 등에 의해 추동되고 있다. 특히 파마코지노믹스, 파마코제네틱스, 파마코프로테오믹스. 파마코메타볼로믹스 등에 의해 발전하고 있으며, 이러한 학문적 발전에 의해 새롭게 발굴되는 바이오마커가 점점 증가하고 있다.
○ 분자진단은 과거에는 감염진단에 주로 사용되었으나 최근에는 환자 그루핑, 약리효과 범위설정, 독성회피, 치료효과 모니터링, 질환발생 징후예측 등에 사용된다. 분자진단에서 가장 핵심적인 역할을 수행하는 바이오마커는 후생유전체학에 기반한 바이오마커, 질환과 환경간의 관계를 밝혀줄 수 있는 Methylation 바이오마커, 항체 어레이를 통한 스크리닝 혹은 단백질 발현 양상을 통해 스크리닝이 이루어지는 단백질 바이오마커, 그리고 약리대사 작용메커니즘을 확인하고 치료효과 등을 모니터링하는데 사용되는 메타볼라믹 바이오마커 등을 통해 질환의 진행상태나 치료효과의 진행상태를 진단하는데 사용된다.
○ 하지만 바이오마커 관련 유전체학, 단백질체학, 대사체학의 발전, 대용량고속분석기술 등에도 불구하고 바이오마커로서 FDA 인증을 받은 것은 두 개에 불과하다. 이는 지금가지 제출된 바이오마커들이 민감도와 특정성에 있어서 충분한 정도의 신뢰성을 확보하지 못한 것이 가장 큰 이유이다. 특히 바이오마커의 특정성이나 민감성 문제는 대량의 잠재적 환자군에 대해 적용되는 것을 어렵게 만들고 있는데, 정확한 진단은 환자개인별 맞춤형으로 이루어질 때 가능할 경우가 많기 때문이다.
○ 특히 지금까지의 연구결과에 의하면 질환 후기 단계에서는 바이오마커의 유용성이 입증되었으나 초기 단계에서 정확도 증가율은 10% 이내라는 점이 스위스의 심혈관질환 환자를 대상으로 한 실험에서 드러났다. 따라서 보다 높은 정확도, 조기진단이 가능하기 위해서는 임상의학정보와 생명정보의 통합, 시스템생물학적 기초연구 성과를 보다 적극적으로 활용하는 것이 중요한 과제로 제기되고 있다. 특히 현재 우리는 인간 유전자의 40%(8천개)에 대해 파악하지 못하고 있는데, 40% 수준의 미확정성을 가지고 질환 혹은 대사 등과 관련된 시스템 모델을 수립하는 것은 매우 어려운 것이 사실이다. 따라서 의약개발 생산성 향상 혹은 바이오마커를 이용한 예측의학이 발전할 수 있는 최선의 방법은 나머지 유전자에 대한 분석인데, 이를 위해서는 connect to decode같은 방식을 활용하는 것이 효과적이다.
○ 유전자 변형은 싱글포인트에서 발생하기 보다는 구조적 차원에서 발생하는 것이 더욱 크고 중요한데, 현재 이들 변이에 대한 국제적 공동연구는 현재진행형으로 다양한 질병이 구조변이와 연관되어 있음이 입증되고 있으나 완전한 이해를 위해서는 아직 해결해야 할 과제들이 더 많다. 이와 관련 구조변이에 관한 연구는 1000 Genome Project를 통해 수행 중인데, 현재 개발된 대부분의 분자진단 기술 혹은 바이오칩은 싱글포인트 뮤테이션을 진단하는 것이기에 구조변이를 포착하기 어렵다. 현재 구조변이와 관련된 유전자 분석 프로제트인 1000지놈프로젝트에 참여하고 있는 유전자 분석전문기업인 Life Technologies, 454 Life Sciences (a Roche company), Illumina Inc는 새로운 시퀀싱 기술을 개발하는데 선도적 역할을 수행하고 있어서 주목할 필요가 있다.
○ 특히 미국 NCI가 1999년에 조직적이고 통합적인 개발을 위해 Biomarkers Developmental Laboratories (BDL), Biomarkers Reference Laboratories (BRL), Clinical Epidemiology and Validation Centers (CEVC), Data Management and Coordinating Center (DMCC)등 4개의 그룹으로 구성된 컨소시움을 구성한 조기 예후진단 관련 통합적 연구개발을 시도했으며, 그 결과를 이어 최근 본격화된 CPI(Critical path Initiative)의 경우, 1. 질환의 예후나 진행상태 혹은 질환관련 마커의 메카니즘 등을 밝혀 이를 임상시험에 활용하기 위한 진보된 평가 툴 개발, 2. 임상시험을 위한 전체과정의 합리적 설계, 임상시험 프로토콜 개발, 임상성공 판정지표의 개선 등을 주로 연구하기 위한 임상시험 과정의 개선, 3. 임상시험 시뮬레이션, 임상실패 분석, 부작용 발생 원인에 대한 데이터마이닝 등에 관련된 바이오인포매틱스의 강화, 4. 각종 바이오마커 및 약물작용이나 약물반응 메커니즘 분석을 통해 보다 안전하고 효과가 높은 바이오제품 생산을 위한 공정개선, 엔지니어링 기술을 개발하기 위한 21세기형 제조업으로의 진전, 5. 감염성질병, 헌혈 모니터링, 각종 질환에 대한 동물모델 개발 등과 관련된 공공의료수요에 대한 대응제품 개발 등을 목표로 진행되고 있다.
6. 비즈니스모델의 변화와 지식서비스의 시장의 성장
구조변화의 압력들
○ 영국 정부에서 추진하고 있는 약효와 약가의 비교평가를 통한 신약가격 결정 메카니즘을 도입한 NICE 프로그램을 필두로 미국이나 유럽 등 선진시장을 중심으로 정부나 환자로부터 의료비용 감축에 대한 요구가 높아지고 있으며, 동시에 특허만료로 인한 개량신약 기업들의 빠른 성장, 파머징 국가군에서 개량신약 전문기업과 혁신신약 기업들간의 격화되는 경쟁, 또한 약가인하를 위한 사회적 압력이 점정 증대하고 있으며, 의약 및 의료서비스 시장의 특성상 수요자 협상력이 높은 상황에서 의약기업 연구개발 생산성 약화는 의약산업 전반에 걸친 구조적 위기를 강제하고 있다. 한 연구결과에 따르면(Review of Drug Discovery, 2010, Nov) 특허만료 및 연구개발 생산성 악화로 인해 2007년부터 2016년 사이에 일어날 것으로 예상되는 매출액 손실분의 26%만이 신규신약 개발을 통해 회복가능할 것으로 예측하고 있다.
대표적 블록버스터 특허만료 현황-예시
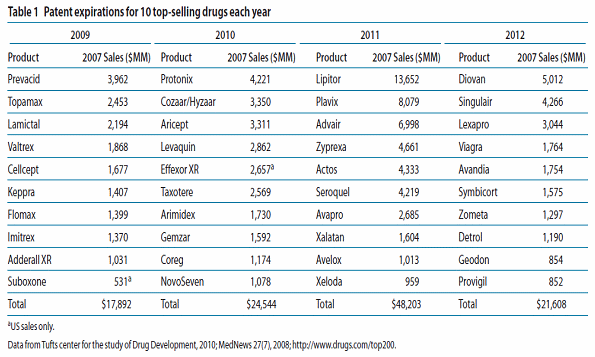
○ 특히 특허만료로 인한 시장점유율 하락과 관련해서는 단일품목 40억 달러 매출액을 자랑하는 Singulair가 2012년 특허만료되고 80억 달러 매출액을 자랑하는 Plavix는 2011년, 130억 달러 매출을 기록하는 Lipitor의 경우는 2010년에 특허만료 되는 등 매출액 10억 달러 이상을 기록하고 있는 블록버스터급 신약 중 35개가 특허만료를 앞두고 있다. 하지만 이를 대체할 수 있는 신약개발은 오히려 점점 줄어들고 있다. 여기에 영국의 엄격한 약가평가제도, 미국의 오바마 의료개혁 등으로 인해 세계적 차원에서 약가인하 압력이 점점 높아지고 있다. 이러한 구조적 위기는 최근 급격하게 증가한 M&A의 물결로 나타나는가 하면 비용합리화를 위한 의약개발 및 생산과 분배 프로세스의 외주화, 그리고 신약 파이프라인 확장과 라이프사이클 매니지먼트를 위한 후보물질 아웃소싱, 그리고 새로운 형태의 창조적인 산학연 협력모델을 기반으로 한 Virtual Firm 모델 등 다양한 대안들이 모색되고 있다.
○ 이런 점들로 인해 메이저 의약기업은 부채가 적고 현금보유량이 많으면서도 시장에서 자본을 조달하는 것이 10년전에 비해 훨씬 어려워졌는데, 투자자들은 투자가치의 기준을 파이프라인의 숫자로 판단하기 때문이다. 특히 바이오산업에서 투자자들의 기대수익율 10%+&을 가정할 경우 200년에 300억 달러의 매출을 기록하고 있는 바이오기업은 2008년에는 530억 달러 이상의 매출을 달성해야 주가유지 및 투자유치 흐름을 지속할 수 있게 된다. 그러나 03년에 10억 달러 이상 매출액 제품이 53개 였음에 반해 2008년에는 21개만이 블록버스터 모델에 해당하며, 앞으로도 이러한 경향은 당분간 지속될 것이다. 특히 대부분의 메이저 기업들은 지속적인 투자자 유인을 위해서 해당 기업의 성장률을 10% 근방에서 맞추어야 하는데, 이러한 목표치를 달성하기 위해서는 매년 2-4개의 신약을 출시해야 한다. 하지만 최근 임상성공율을 고려할 때 (상대적으로 높아지기는 했지만) 아주 많은 수의 후보물질을 가능한 한 많이 확보해야 한다. 하지만 하나의 기업이, 제아무리 글로벌 제약기업이라 하더라도, 전세계에서 새롭게 발굴되는 후보물질의 총량에 비교하여 약 1% 이내를 자체 발굴하고 있는 상황에서는 거의 모든 제약사들이 전세계적 범위에서 후보물질 아웃소싱을 진행해야만 안정적인 파이프라인 경영이 가능하다는 결론으로 이어진다.
개방형-병렬형 비즈니스 모델-예시
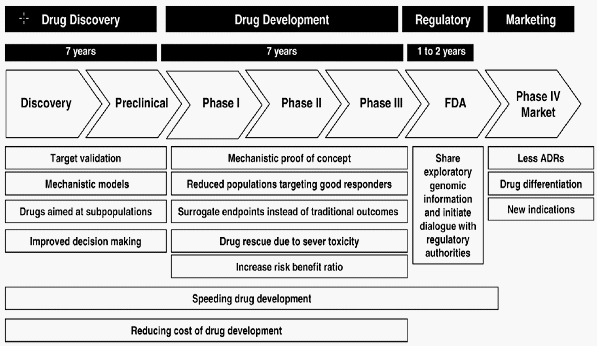
○ 결국 이러한 상황은 제약기업의 연구개발 경영전략에 있어서 다음과 같은 복잡한 기술적-경영적 과제를 제기하게 된다. 이 중에서도 가장 중요한 것은 타겟마켓 선정(블록버스터/멀티버스터/니치버스터), 파이프라인 관리(동시병렬적 파이프라인 관리 및 신규와해성이 높은 후보물질 아웃소싱), 신약개발 프로젝트 기획(반복적인 순환형 임상전제 신약설계), Virtual Firm 모델을 통한 와해성 혁신 추구 (기초원천 연구단계에서의 공동협력을 통한 와해성 플랫폼 개발 및 신규 전략 포트폴리오 발굴), 기존 개발된 제픔의 효능범위를 확대하기위한 제품재정위, 결합신약 발굴 등과 같은 멀티버스터 전략, CMO와 CRO등을 활용한 비용절감형 아웃소싱, 그리고 조직내부적으로는 판매영업부문의 축소, 선형단선적 연구개발 라인의 재구성 등이 있다.
○ 이에 따라 글로벌 제약사들의 Integrative Business Model 선택과 개방형 혁신체제를 활용한 아웃소싱으로 인해 각 개별 프로세스에 전문화된 DBF의 활성화를 통해 가능해진 사업모델로서 신약개발 플랫폼 기술의 확보와 바이오신약 개발 전체 프로세스에 대한 전문화된 지식정보 인텔리전스 시스템 구축에 경쟁적으로 나서고 있다. 이러한 글로벌 기업들의 노력은 특히 임상 초기단계의 라이센스 인, M&A의 증가로 나타나거나 아웃소싱 서비스의 적극적 활용, Virtual Firm 모델의 등장, 그리고 기초원천 단계에서의 산학연 공동협력 강화 등을 통해 나타나고 있다.
의약산업이 직면한 기술-경영측면의 전략적 과제
○ 앞서의 분석을 통해 이미 지적된 것이지만, 비용절감을 위한 아웃소싱이나 M&A등은 단기적인 수익성 해소를 위한 단기적 처방의 성격이 강하다. 실제로 2007-2009년 사이에 진행된 M&A의 결과를 살펴보면, M&A로 인한 매출액의 상승, 매출포트폴리오 강화 효과는 가시적으로 드러난 반면에 신약개발 연구개발 생산성 강화 효과는 아직까지는 명시적으로 드러나고 있지 않다. 하지만 1990-2000년 사이에 진행된 거대인수합병의 결과를 분석한 연구결과 역시 연구개발 투자대비 신약승인 개수를 분석해보면 인수합병 후에 오히려 생산성이 낮아지는 결과를 보여주고 있다.
인수합병이 연구개발 생산성에 미치는 효과
○ 이는 최근의 M&A열풍 역시 몇몇 예외적인 경우를 제외한다면 파이낸셜 측면의 이해관계가 압도적으로 작용하고 있는 것으로 보인다. 하지만 이는 지속가능한 전략이라고 하기 어렵다. 규제의 강화, 가격하락의 압력, 특허만료, 일반의약품 기업의 경쟁압력 등과 같은 전반적인 시장상황의 악화, 연구개발 생산성의 전반적 하락 등으로 인해 위와 같은 보수적인 전략이 채택되는 것은 충분히 이해할 수 있으나 위기를 가져온 원인들이 모두 구조적인 차원의 것들이라는 점에서 지금 와해성 혁신을 추구하지 않는다면 장기적인 성장 가능성에 발목을 잡게 될 것이다.
개방형 혁신과 지식서비스 시장의 성장
○ 우리가 보다 주목해야 할 구조적인 변화의 흐름은 단기적인 차원에서의 위기해소를 위한 방안과는 달리 중장기적인 연구개발 전략 포트폴리오의 변화양상이다. 백신, 줄기세포, RNAi 분야 등과 같은 신규 비즈니스 라인으로의 적극적인 진입, 중개의학과 임상정보 지식관리를 통한 타겟선정의 정확도와 임성성공율 제고, 그리고 바이오마커를 이용한 니치타겟 발굴을 통해 Market Segmentation을 보다 정밀하게 설계하는 방안, 후보물질 아웃소싱을 확대하는 방식으로 보다 창조적인 라이프사이클을 관리하는 방안, 기초원천 연구 공동연구협력 성과를 활용한 연구개발 전문 위성회사 설립 등의 경향이 나타나고 있다.
바이오의약산업의 전략적 선택
○ 이와 관련하여 글로벌 제약기업들의 전략적 선택을 주목해볼 필요가 있다. 그 중에서 특기할만한 것으로는 첫째, 약물발굴 단계에서 와해성 혁신을 촉진하기 위한 조직규모의 슬림화, 경영계선의 단축, 단위조직에 대한 과감한 권한위임이 일어나고 있다는 점이다. Eli Lilly는 Chorus 프로그램을 통해 외부 CRO를 활용한 비용 및 개발기간 단축을 성공적으로 실현하고 있으며 평균 기간단축 10개월, 비용절감 1500만에서 320만으로 5배 이상 감축했고 이를 바탕으로 인도의 시알오인 Jubilant Organosys사와 함께 2차 프로그램인 Vanthys 프로그램 운영 중이며 GSK는 CEDD 프로그램을 통해 20명 단위의 소그룹을 구성한 뒤 최대한 자율권을 부여함으로써 창조적이고 혁신적인 약물발굴, 약물발굴 과정에서 다양한 관련 조직이나 지식이 통합될 수 있는 구조로 성과평가를 진행하고 있다. 화이저의 경우에는 Biotherapeutics and Bioinnovation Center를 통해 5-10개의 바이오벤처기업 연구개발 네트워크를 구성하여 드럭 발굴을 시도하고 있다. 특기할만한 점으로는 이들 모든 프로그램이 자체의 별도조직을 구성하고 기존 조직구조와는 독립적인 활동이 보장되는 방식으로 운영된다는 점이다. 노바티스사의 경우 바이오마커를 활용한 병렬적 약물개발 방식을 적용하고 있는데, 이러한 방식을 통해 약물개발에 통상 12년이 걸리던 과정을 5-6년 정도로 단축시킬 계획이다(IBM Pharma, 2010)
○ 둘째, 신생기술 기반 새로운 사업영역으로의 진출, Open Innovation 체제의 도입, 그리고 아웃소싱 범위의 확대 등으로 인해 기업내부 구조 개편의 중심축이 지식창조와 지식관리로 모아지고 있다는 점이다. 이러한 전략적 전환의 중심에 자리잡고 있는 Open Innovation의 경우 전세계적 범위에서 진행되고 있는 연구개발에 관련된 지식정보, 효율적 아웃소싱을 위한 프로젝트 관리와 전략적 코디네이션, 과학적 연구성과의 비즈니스 모델화, 광범위한 임상 및 중개의학 지식관리 및 이를 활용한 약물설계 등이 매우 중요한 과제가 된다. 이러한 상황에서 기업내 지식관리 및 지식창조는 기업경쟁력의 핵심을 구성하게 되며, 최근 Merck사나 화이저, 노바티스 등이 와해성 혁신을 전담하는 특별한 독립부서로서 각종 센터를 설치하고 있는 것 역시 이러한 흐름을 반영하고 있는 것이다.
○ 셋째, 줄기세포 상용화 시점이 향후 5년 이후에나 본격화 될 것이라는 일반적인 전망과는 달리 글로벌 제약기업을 중심으로 줄기세포 기반 치료제 개발, RNAi 기반 치료제 개발 등 와해성 신기술 투자에 적극 나서고 있다. 화이저는 위스콘신대학과 줄기세포 공동연구개발 협력을 체결하는가 하면 런던대와 함께 황반변성 줄기세포 치료제 공동개발에 착수했으며 GE는 Geron, Cytori와 공동연구개발 협약을 맺어 줄기세포 시장에 진출을 준비하고 있으며 노바티스 역시 Epistem사, Opexa사와 함께 줄기세포 기반의 신개념 치료제 개발 및 약물 스크리닝 기술개발에 대한 공동협력에 관한 계약을 체결했다(Frank L Douglas, Review of Drug Discovery, 2010) 로슈사는 Roche-CDI, CDI-Therapy & Explrolation of Monogenic Disease의 신경세포 공동 개발, Roche-Havard Stemcell Ins간의 대사 및 심장관련 질환의 세포모델 개발을 위한 공동프로젝트 등이 있다. 또한 대부분의 제약기업들은 직접 줄기세포 연구팀을 구성하던가 아니면 계열 벤처펀드사를 통해 줄기세포 전문기업에 대한 금융투자를 통해 직간접적인 연계고리를 형성하는데 매우 적극적이다. 가령 J&J가 미국의 Noveocell사에 대한 벤처투자를 진행한 것이 그 대표적 사례이다. 독일의 머크 계열사인 Darmstadt 역시 줄기세포 전문기업인 Milipore사를 인수하는데 76억 달러를 지불했으며, 09년에는 사노피아벤투스가 Salk Institute사의 세포관련 연구개발시설을 지원하기로 했는데, 이 연구소를 통해 얻어진 연구결과를 활용하고자 하려는 의도에서 시작되었다.
○ 넷째, 위성기업 창업의 형태나 혹은 대학이나 연구소를 중심으로 한 Virtual Firm 모델의 등장이다. 이들 사례들은 의약산업의 합리화를 향한 구조조정의 흐름과는 달리 와해성 신규시장 진입을 위한 신규투자의 한 형태로 등장하고 있는 것으로서 향후 새로운 시장창출의 모습을 추측하기에 가장 적합한 지표라고 할 수 있다. 또한 대기업을 중심으로 신규기술을 활용한 신약개발(mRNA, RNAi, 치료백신, 합성생물학이나 줄기세포 등)의 경우 라이벌간의 공동연구개발이 활발하게 진행되고 있는 것도 주목할만하다. 가령 또한 ISIS와 Alnylam사의 mRNA신약개발 프로그램 혹은 GSK와 화이저사의 HIV 치료제 개발 공동협력, Elililly, Merck, 화이저 사가 의약개발 플랫폼 기술을 개발하기 위한 Puretech Venture라는 죠인트 벤처를 설립한 뒤 이를 통해 바이오마커와 이미징 기술, 그리고 예측적 독성학 분야에 특화된 Enlight Biosciences사에 대한 투자를 진행한 사례나 약간의 시차를 두고 J&J사가 이 투자에 합류한 것이 대표적인 사례이다. 이는 향후 신약시장의 연구개발 패턴이 초기연구, 초기 개발 단계가 대폭 확장되는 반면에 후기개발이나 제조 단계 혹은 판매나 마케팅 분야의 비중이 줄어들게 되는 트렌드를 고려해 보아도 적절한 선택이라고 할 수 있다.
○ 초기단계에서의 공동협력 혹은 컨소시움 중 대표적인 사례로는 EU 차원에서 진행되고 있는 Innovative Medicines Initiative, Biomarkers Consortium, Predictive Safety Testing Consortium, European Bioinformatics 등이 있으며 GSK와 Novartis의 경우 아열대성 질병에 관한 질환정보 DB를 공개함으로써 관련된 치료제 개발 활성화에 기여하고 있으며 Eli Llily사의 경우 Phenotypic Drug Discovery initiative를 운영하고 있고, Merck사는 세계 1위를 자랑하는 Mayo Clinic, 대학병원들과 함께 네트워크를 구축하고 있는데, 대표적인 것이 Sage Bionetworks, Merck Oncology Collaborative Trials Network등이다. 또한 미국내 다발성 질환을 중심으로 신약개발 공동프로젝트가 구성되어 운영되고 있는데, The Coalition Against Major Diseases (CAMD)의 경우에는 NIA, FDA등과 같은 공공기관과 함께 BMS, 아스트라제네카, Eli Lilly, GSK, Pfizer, J&J, Novartis 등 민간기업이 공동참여하는 Public Private Partnership이 구성되어 있다.
○ 이러한 컨소시움 구성을 통해 대기업들은 자사가 보유하고 있는 라이브러리를 공개하고 바이오벤처기업 들과 약물발굴 및 설계를 위한 공동의 지식정보 검색을 진행하거나 FDA등이 제공하는 공공 라이브러리와 연구개발 결과를 활용해서 자사의 후보물질을 개발하는 방식을 취하고 있다. 이와 관련하여 글로벌 제약기업의 경우 이러한 과정을 통해 얻어진 성과의 상업화에 유리하지만 중소규모의 바이오기업은 컨소시움을 통해 공동기술개발권을 확보하는 대신 시장진입 장벽 등으로 인해 자사만의 독자적인 상업화에는 불리한 구도가 만들어지는 것은 분명하다. 하지만 이러한 불리한 환경에도 불구하고 바이오전문기업들이 컨소시움에 참여하는 이유는 이 과정에서 자사가 보유하고 있는 핵심기술을 보다 좋은 조건으로 이전할 수 있거나 공동 컨소시움을 통해 얻어진 거대기업의 지식자산을 공유, 혹은 연구개발 성과를 활용할 수 있는 자격을 획득한다는 점에서, 또는 중장기적으로 참여기업의 투자매력도 증가 등을 고려한 결과라고 할 수 있다.
○ 글로벌 대기업이 참여하는 컨소시움과는 달리 보다 개방적이고 유연한 형태의 개방형 연구개발협력의 대표적인 사례로서는 CollabRx, the Pink Army, Open Source Drug Discovery (OSDD), and the African Network for Drug and Diagnostics Innovation 등이 있다. 이들은 대표적인 개방형 의약기술 공동개발 프로그램들로서 중개연구가 중심적 역할을 수행하게 되지만 다학제적 특성과 다양한 지식의 종합, 조정, 예측역량이 필요한 과제로서 높은 창조성과 대가의 시각을 요구한다. 중개연구는 그 특성상 엔지니어링과는 달리 복잡하고 질서가 없으며 분명하게 정의되기 힘들기 때문이다. 느슨하게 연계된 다학제적 지식과 정보들을 하나의 퍼즐조각처럼 맞추기 위해서는 전체적인 그림에 대한 상상도를 먼저 그려야 하며, 대개 이러한 작업은 해당 분야의 대가들이 가질 수 있는 창조적 상상력을 요구하기 마련이다.
Virtual Firm 모델의 등장
○ 영국 City University의 Baden Fuller 교수가 영국 Engineering and Physical Sciences Research Council (EPSRC)의 지원을 받아 수행한 연구결과에 따르면 2000-2008년 사이에 68개의 대학 및 연구소에서 창업한 바이오 관련 기업 중 2/3가 Virtual Model을 채택했으며, 이들 Virtual Firm 모델의 성공요인 중 가장 중요한 것이 지식관리에 있음을 확인했다. 또한 버츄얼펌 모델은 질환분야를 가리지 않고 모든 분야에 걸쳐 적용 가능하다는 사실도 발견했다(Financial and Organisational Innovation in UK Biotech, EPSRC, 2010. Dec). 이러한 버츄얼펌 모델이 성공하기 위해서는 아주 강력한 지식역량을 가진 프로젝트매니저가 이사회를 구성해야 한다는 점. 해당 프로젝트 실행을 위한 아웃소싱 전략설계와 해당 과정 전반에 대한 강력한 지도력과 네트워크 역량이 필수적이라는 점이다. 단점으로는 전략적 기획과 프로세스 통하벌계를 제외한 대부분의 과정을 외부역량에 의존해야 하기에 효율적인 의사소통과 각 과정에 대한 통제력의 약화, 개발 기간의 지연 가능성에 관련된 문제들이 있으며, 가장 어려운 과제 중의 하나가 자금이 풍부하지 못한 초기단계에 세계적인 역량을 가진 전략기획 전문가를 영입하는 문제였던 것으로 밝혀졌다.
○ Open Source Drug R&D 프로그램을 통해 만들어진 다양한 질환관련 데이타베이스와 오믹스 데이터들을 이용한 약물개발 프로젝트가 진행되고 있는데, CollabRx, Pink Army, Open Source Drug Discovery (OSDD), African Network for Drug and Diagnostics Innovation 등이 대표적이다. 이 들 중에서 지난 10여년간 3억 15백만 달러를 투자한 Medicines for Malaria Venture의 경우 50여개의 말라리아 치료제 개발 파이프라인을 구축하는데 성공했다. 기존 비즈니스모델의 고정비용을 모두 가변비용으로 전환하고 전체 프로세스의 자본투입비용을 최소화하는 방식으로 운영되는 Virtual Firm 중에서 Ce;tic Therapeutics LLP는 펀딩과 동시에 전체 프로세스의 아웃소싱을 통해 임상을 진행한 후 메이저 제약사에 판매하는 방식으로 운영되고 있는데 이들은 대개 임상2상에 있는 제품을 구매한 뒤 3상 진입시킨 후 거대제약사에 판매하는 방식으로 운영되고 있다. CELTIC THERAPEUTICS LLP는 사모펀드를 운영하는 관리팀, 제품개발의 전과정을 아웃소싱하는 바이오메디칼 개발팀으로 구성되어 있는데, 양 팀 모두 고도의 전문가 소수로 구성되어 있다.
○ 공공의 성격이 보다 강한 또 다른 Virtual Firm 모델로는 Myelin Repair Foundation의 Accelerated Research Collaboration™ (ARC™) 모델이 있는데, Myelin Repair Foundation은 2002년에 다발성경화증(multiple sclerosis) 환자들이 조직한 재단으로서 효과적인 치료제 개발을 위해 설립되었다. 2004년 Accelerated Research Collaboration Model을 제시하고 60개 이상의 병원, 바이오기업, 연구소, 환자그룹 들을 연계하여 5년 이내 효과적인 치료제 개발을 완료한다는 목표로 Virtual Project를 출범시켰는데, 현재까지 19개의 치료제 후보물질 개발, 15개 특허취득 및 출원, 35백만 달러의 자금조달에 성공했다. ARC모델의 주요 구성요소로는 Research Focus의 경우 신규치료제 개발이 필요한 영역을 정의하는 것을 주 업무로 하고, Discovery Biology의 경우는 질환 치료제 개발과 관련한 주요 과제에 대한 세계적인 전문가를 발굴하는 역할을 수행하고, Management팀은 전체 프로세스의 효율적 관리를 기업조직으로서 운영되고, Scientific Oversight팀은 약물개발과 관련한 전체적인 설계를 위한 전문가 자문그룹을 운영하며 Business Oversight는 전체 팀 운영 및 재정상황을 모니터링 및 관리하는 이사회로 운영되며 Translational Research/Target Validation and Drug Discovery Networks는 임상시험 및 기술이전을 위한 데이터 산출 및 연구결과 품질관리를 담당하고 BioPharma Development와 Clinical Research는 각각 기술이전에 따른 제품개발 프로세스에 대해 제약사들과 조기에 협의를 진행하는 역할과 임상진행을 위한 임상과정 사전설계에 주력하고 있다.
○ Virtual Firm모델을 기반으로 독자개발과 공동개발을 동시에 추진하고 있는 Vertex Pharmarceutical은 1989년에 미국 캘리포니아 샌디에고에서 설립되었으며 핵심적인 공동개발 파트너로는 Tibotec Pharmaceuticals, Cystic Fibrosis Foundation Therapeutics, Mitsubishi Tanabe Pharma Corporation등이 있고 MIT대학이나 J&J의 자회사인 Jansen등과 함께 Viral diseases, cystic fibrosis, inflammation, autoimmune diseases, cancer 등에 관한 소분자화합물 치료제 개발에 주력하고 있는 기업이다. Vertex는 아래의 그림에서 볼 수 있듯이 외부자원에 보다 많은 노력을 기울이고 있는 기업으로서 자체 연구개발보다는 전략기획, 지식관리, 외부자원 인 소싱을 통한 와해성 신개념 치료제 개발에 집중하고 있다. 2010년 현재 9억 8천만 달러의 현금보유, 8개의 제품이 임상을 진행중이며 1개가 시판승인을 얻었고 2개가 임상 3상을 진행중에 있다.
지식정보 중심의 기업경쟁력과 서비스 시장의 성장
○ 바이오산업에서의 오믹스 관련 지식정보나 임상정보 지식서비스를 제외한 좁은 의미에서의 바이오비지니스인테리전스 시장은 2009년 4억 95백만 달러에서 2012년 5억 55백만 달러로 성장률 25% 이상 증가하고 있는 것으로 나타났다. 비즈니스인텔리전스 시장의 성장원인으로는 수요측면에서 효율적 생산라인 관리, 파이프라인 확보와 비용경쟁, 그리고 무수한 정보양상에 따른 효율적이고 체계적인 지식관리의 필요성, 맞춤형의약 시대로의 이행에 따른 공정설계 합리화, 연구개발의 글로벌화와 가치사슬의 세분화 등을 들 수 있다.
○ 특히 빠르게 성장하고 있는 보다 비즈니스인텔리전스 서비스 시장의 성장원인을 구조적인 차원에서 살펴본다면, 폐쇄형 연구개발전략에서 개방형 연구개발전략으로 전환되고 있는 바이오의약산업의 기술패러다임 변화에 힘입은 바가 크다고 할 수 있다. 또 다른 구조적 요인으로는 의약, 기기, 의료서비스가 통합되는 추세를 보임에 따라 분야별 기술-비지니스 지식정보 융합의 필요성이 증가하고 있기 때문이며, 항체, 백신, 줄기세포, RNAi, 분자진단 등 바이오의약 시장의 확장과 분화가 빠르게 진행되고 있는 점, 유럽과 미국 중심에서 브라질, 인도, 러시아 등 새롭게 등장하고 있는 파머징 국가의 시장 성장에 따른 각종 지식정보의 필요성 확대 등으로 인한 것이다.
비즈니스인텔리전스 최신모델
○ 바이오산업에서의 지식서비스는 크게 네 가지로 구분가능하다. 첫째, 산업동향, 지역동향, 기업동향, 제품 파이프라인, 기술개발동향 등을 제공하는 분야로서 대표적인 기업으로는 DataMonitor, Frost&Surlivan, Business Insight, Market Research, Freedonia 등이 있고 최근에 활발하게 성장하고 있는 업체로는 BioCentury, Alacrita, SHI Consulting, Genome Consulting, Immunobiochem Consulting Company, BiotechConsulting, AshBiotech Consulting등이 있다. 둘째, 각종 오믹스 정보나 질환에 관한 임상정보 데이터베이스를 분석, 가공함으로써 의약개발기업이나 의료서비스 기관에 대해 필요한 지식정보를 제공하거나 혹은 효력이나 독성 등과 관련된 지식정보를 제공하는 등 기술적 분야에서의 전문지식정보를 제공하는 기술컨설팅 서비스가 있다. 셋째, 원격의료나 맞춤형 헬스케어 서비스 제공과 관련된 다양한 지식정보를 가공, 생산, 제공하는 의료서비스 중심의 지식정보서비스가 있다. 넷째, 인수합병, 기술거래, 기술투자 등 경영전략과 관련된 지식정보를 제공하는 비즈니스 인텔리전스 등이 있는데, 이들 각각의 영역이 서로 엄격히 분리되는 것이 아니라 하나의 기업이 두 세개 이상의 영역에 관련된 서비스를 통합적으로 제공하는 것이 일반적인 모습이다.
○ 오믹스 정보에 기반한 지식서비스 시장은 지난 10년간 7% 성장에서 향후 20% 이상의 고성장이 예상되는 시장으로서 2008년 현재 총 265억 달러에서 2015년 416억 달러로 성장할 것이다. 그 중 가장 빠르게 성장하고 있는 분야로는 의료 및 의약개발 관련 지식정보로서 시장 규모는 총 30억 달러(의약개발 부문의 경우는 20억 달러)로 의약개발 아웃소싱, 지식기반 생산성 강화 노력에 따라 더욱 빠르게 성장할 것으로 예상된다. Personalized Healthcare 서비스(2004년 10억달러->2015년 340억 달러), 에너지 소재, 농어업 작물개량, 환경정화 등의 신생산업 분야는 향후 10~15년간 약 30% 이상의 고성장이 예상되는 분야로 본격적 산업화를 위해 생명정보 및 이의 활용과 관련된 각종 지식정보의 역할이 매우 중요해지고 있다.
○ 미국은 연간 29억 달러를 유전자분석을 위해 지원하고 있으며 영국은 NHS를 통해 의료임상 정보 통합시스템 구축에 향후 10년간 총 40억 달러를 투자하고 있다. 또한 중국, 인도, 브라질 등 신흥성장국 중심으로 바이오정보를 활용한 각종 산업이 빠른 속도로 성장하고 있는데, 중국의 헬스정보 시장은 현재 159백만 달러에서 2016년 413백만 달러로 성장 전망, 년평균 성장율 17%를 보여줄 것으로 예상되고 있다. 특히 점점 확장되고 있는 개방형 연구개발전략을 적용하기 위해서는 기술-비지니스-임상-오믹스 정보의 통합적 분석이 필수적인데, 이와 관련되어 가장 핵심적인 과제가 데이터 통합, 대규모 데이터 처리 및 관리, 대규모 데이터로부터 유의미한 지식을 발굴, 생산하는 것이라고 할 수 있다.
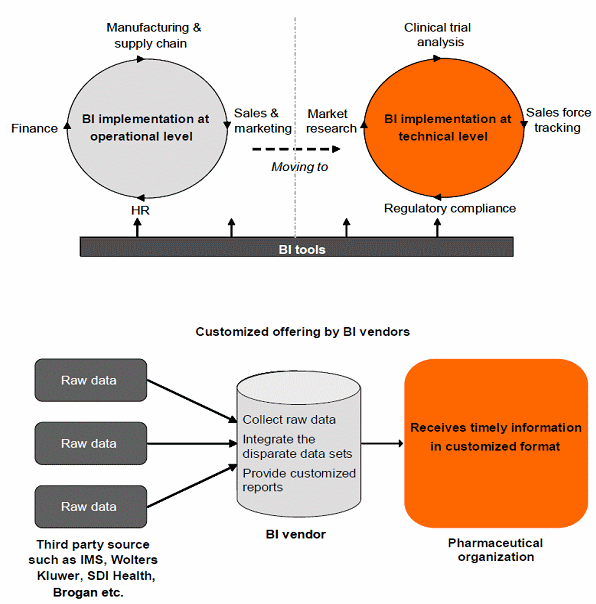
○ 바이오정보 생산 산업의 총 시장규모는 30억 달러이며 년평균 성장률은 13%로, 유전자 분석기, 단백질 분석기, 메타볼로믹 분석기, 휴대형 중단기 등 장비 및 도구산업을 중심으로 발전하고 있다. 대표적인 기업으로는 Symx, Accelrys, Tripos, Agilent, DNAstar, Compugen(인스라엘), Optribrium(영국), StrandGenomics(인도)등이 있으며 이들 기업의 년평균 매출액은 8천만 달러 내외이다. 이 중에서도 정보생산기술은 1980년대 이후 지속적으로 성장해 왔으며 최근에는 완전인간 유전체 분석에 소요되는 비용은 1만 달러 수준까지 하락하는 등 기술적 성숙도가 상대적으로 매우 높은편 (2000년 기준 완전인간유전체 분석비용은 5억 달러)인데, 2007년 이후 생명정보 생산을 위한 도구 및 장비시장의 경우 대기업간 흡수합병(Symx와 Accelrys사간의 합병) 등이 진행되면서 독점적 시장경쟁 구조로 진입할 것으로 예상된다. 바이오정보 생산분야의 기업들은 전통적인 도구 및 장비 개발 및 판패를 주력으로 한 비즈니스 모델에서 Schrodinger와 Simulation Plus의 통합정보처리시스템 개발에서 볼 수 있듯이 통합적 분석서비스 패키지 시스템 개발 등 지식관리-지식생산 분야로 이동 중이다. 특히 지노믹스 분야에서 대표적인 기업으로는 Affimetrix, Applied Biosystems, Agilent Technologies등이 있다. 프로테오믹스 분야에서는 Agilent Tech, Applied Biosystems, Biowisdom, Bruker Daltonics, Geneva Bioinformatics, Genelogics, Health Discovery Corp, Vermillion등이 있다. 메타볼로믹스 분야의 경우는 Ariadne genomics, GeneGo, Ingenuity Systems, BG Medicine, Cellnomica, Compugen, Curagen, Entolos, Genstruct, Genomatirx 등을 비롯한 12개 기업이 있다.
○ 바이오정보 관리 및 유통산업 분야는 총 50억 달러 내외로 추정되며 유전자 발현분석시장(2006년 11억 달러에서 2012년 24억 달러로 성장), SNP분석시장(2007년 6억2천만 달러에서 2012년 22억 달러로 성장), 메타볼로믹스 시장은 최근 급성장하는 분야로 전체 오믹스 100개 기업 중 5개 이내가 메타볼로믹스 시장에 진출하고 있다. 대표적인 기업으로는 Accelrys, StrandGenomics, Genomic Solution, BlueGene, Agilent techs, Prosarix등이 있다. 정보관리 및 유통기술 분야의 경우 기존 IT업체가 참여하거나 IT업체와의 연계협력을 통해 발전하는 경우가 일반적이며 인도의 Infosys, MindTree, Tata등이 세계적 플레이어로 활동 중이다. DataMining, Knowledge Discovery 기술과 관련하여 AI(인공지능), 소프트웨어 설계 기술 등에 특화된 벤처기업이 지식생산 시장으로 진출하고 있으며 이들은 대개 비즈니스 전략개발, 컨설팅 서비스 등을 통합한 패키지형 서비스 제공을 비즈니스 모델로 설정하고 있다.
○ 의약개발 정보서비스 분야의 경우에는 의약개발 생산성 하락, 신규 임상승인 제품의 지속적인 하락현상에 따라 의약개발 아웃소싱 시장은 2010년 96억 달러로 성장률 15%를 기록하여 2015년에 167억 달러로 성장 예상되고 있다. 대표적인 기업으로는 Argenta Discovery, Albany Molecular, BioDuro, Inc. Caliper Life Sciences, Charles River Labs, Covance, Inc, ChemBridge GenScript, Evotec, Inc. Jubilant Biosys, Ligand Pharma, Chemsys Pharmaron, Ricerca Biosciences, Shanghai Medicilon, WuXi AppTec 등이 있다. 특히 연구실기반 임상연구 서비스의 경우는 약물중독, 임신진단, 유전질환 분석, 독성검사나 면역검사 등을 대행하는 분야로서 2009년 527억 달러에서 2015년 650억 달러로 성장 전망되고 있으며 이에 따른 년편균 성장률은 5%로 추정되고 있다. 대표적 기업으로는 Quest Diagnostics and Laboratory, Corporation of America가 대표적인데 이들 기업의 매출액 합계는 120억 달러에 달하고 있으며 주요 수요자층은 공공의료보험기관(50%), 민간보험회사(35%), 특수진료기관(20%), 개인환자(2%) 등으로 분석된다. Bio Reference Lab, Genomic Health Inc, Genzymes 등은 특정질환, 특정 분석영역에 전문화된 기업으로 년매출은 평균 1-3억 달러 내외 수준으로 분석되고 있다.
○ 바이오지식정보 활용분야로는 의약개발 프로세스 설계, 예측기반 임상시험 설계, 헬스리스크평가분석, 인터넷 기반 환자관리 서비스 시스템, 텔레헬스를 위한 전문가 기반 의사결정 시스템 구축 및 서비스 등 다양하고 광범위하게 분포하고 있다. 대표적 기업인 McKesson Corp의 경우 통합정보 시스템 및 솔루션 개발로 년매출 50억 달러 달성하고 있으며 임상시험 설계 및 컨설팅을 제공하는 PhaseFoward는 년매출 1억 7천만 달러의 매출액 기록했다. 지식관리 및 생산 시스템의 핵심적 구성요소인 온톨로지 분야의 경우 Gene Ontologies, OBO, SNOMED, BioPAX, MeSh등이 대표적인 기업이며, 생성된 온톨로지는 Googel Medicine, WIkiproteins, BioWiki등을 통해 공유되고 보다 전문적인 지식정보 수집 및 가공은 Technorati, Delicious 등을 통해 추가 가공되어 대중에 대한 서비스를 제공한다. 지식관리 및 생산을 위한 소프트웨어는 ABrevity, Accelrys, Agilent Tech, Biowisdom, CambridgeSoft, Elesvier MDL, Geospiza, GeneLogics, IO Informatics, KOOPrime, LabVantage, NextBio, Oracle등이 있다. 임상 및 메타볼로믹 연구결과를 수집분석하고 이를 구조화시키기 위한 마이닝 및 서칭 툴을 제공하는 회사로는 QUOSA, Lingumatics, Inforsense, Insightful, Nervana, Velocity등이 있으며 임상연구결과를 활용한 신약개발 설계를 위해서는 Cytel, Axio Research, Phoenix Data Sytem, Clinphone등이 화이저, 노바티스, 밀레니엄파마 등에 대해 공급, 서비스 중이다.
○ 임상연구 기반 지식서비스 분야로는 의사나 인턴에게 임상관련 정보 실시간 제공, PDA를 통한 임상의약정보 제공, 약물 및 질환에 관한 백과사전적 정보제공, 임상관련 정보제공을 통한 의사의 처방결정 지원 등을 수행하는 서비스로서 해당 시장의 연평균 성장률은 12% 내외이나 기업당 수익률은 100%를 넘는 초고속, 고성장 산업분야이다. 대표적인 기업체로는 AccessMedicine Mcgrawhill (의사나 인턴에게 임상관련 정보 즉시 제공 2천7백만 달러), Clin-eguide and Mobile Clin-eguide Kluwer (PDA에 증거기반 의약임상정보 제공 4억9천만 달러), Clinical Xpert Thomson Reuter (약물, 약물작용, 질환, 대체의약 등 정보제공), Micromedex Thomson Reuter (매출액 3억9천만 달러), Epocrates Online Epocrates (8천8백만 달러), Evidence-Based Medicine Guidelines Wiley (응급치료에 필요한 임상정보 제공, 진단/처방/증거관련 자료 제공 1억 9천만 달러 매출), MDConsult Reed Elsevier (임상관련 정보 제공을 통해 치료를 위한 의사결정 지원 1천5백만 의사에 서비스 제공, 2008년 8억1천만 달러 매출) 등이 있다.
아웃소싱 시장
○ 전통적인 아웃소싱 영역으로는 Discovery 단계에서 각종 Omics를 활용하거나 분자진단 마커를 사용한 약효시험 등의 서비스를 아웃소싱하는 것과 Development 단계에서 선별된 기술의 확인 및 발전을 이끌어 내는 단계로서 약물재설계, 표적 다변화, DDS, 패키지 등의 제품 고부가가치화 등에 관한 서비스 아웃소싱이 있다. Production 단계에서는 생산을 위한 임상실험 단계/완제품 생산 단계로서 FDA의 승인을 얻은 cGMP시설을 통해 생산대행 서비스를 제공하는 것이 있으며 해외 시장에 대한 마케팅 단계에서는 생산된 제품을 주력 수요층, 기관 수요자, 병원 등에 대해 판매하기 위한 현지기반의 CSO활용을 통한 유통채널 확보 및 마케팅, 소비자에게 제품 분배 서비스를 활용하는 것이다.
○ 의약품 아웃소싱은 전세계적으로 약 572억 달러이며 2011년 830억 달러에 이를 것으로 전망되며 년평균 성장률은 10% 내외일 것으로 예상된다. 특히 개발단계별 아웃소싱 현황을 살펴보면 과거에는 제조와 관련된 아웃소싱이 다수를 차지했으나 최근 들어서는 임상대행, 약물발굴 등이 빠르게 증가하고 있는 추세이며, 개발단계의 초기에 아웃소싱, 공동협력, 라이센스인 등을 통한 개방형 연구개발 추세가 강화되고 있다.
○ 아웃소싱 시장이 확대, 전문화됨에 따라 아웃소싱을 설계하는 문제 역시 전략적 의사결정의 한 구성요소로 자리잡고 있는데, 핵심적인 문제는 누구를 통해, 어떤 단계의 아웃소싱을 진행할 것인가를 결정하는 일이다. 특히 최근 들어 증가하고 있는 약물발굴 단계에서의 아웃소싱, 혹은 공동연구개발은 주요 대기업들의 파이프라인 고갈 및 연구개발 생산성 강화를 위해 필요불가결한 전략적 구성요소중의 하나로 등장하고 있다.
개발단계별 아웃소싱 현황
○ 또 하나 주목할 만한 현상 중의 하나로는 과거에는 CRO만을 전문적으로 수행하던 임상대행 기관들이 CSO, 즉 마케팅 대행 비즈니스 영역으로 진출하고 있다는 점이다. 이와 함께 글로벌 메이저 기업들은 자체 보유하고 있는 생산시설을 폐쇄하고 아시아 태평양 지역의 위탁 생산기업에게 생산대행을 맡기는 경향이 늘어나고 있는데, 그 한 사례로서 화이자의 경우 20억 달러 규모의 자체 생산시설을 폐쇄하고 전체 생산량 중 15~20%를 위탁생산으로 처리하고 있다.
대표적인 CRO전문기업
|
기업명 |
시장점유율 |
|
Quintiles |
13.0 |
|
Covance |
8.0 |
|
PPD |
6.0 |
|
Charles River |
5.0 |
|
Icon PLC |
5.0 |
|
Paraxel |
4.5 |
|
Kendle |
2.5 |
|
MDS |
2.0 |
|
Others |
54.0 |
|
Total |
100.0 |
CMO회사의 미국내 특허보유 현황
아웃소싱 시장의 성장률
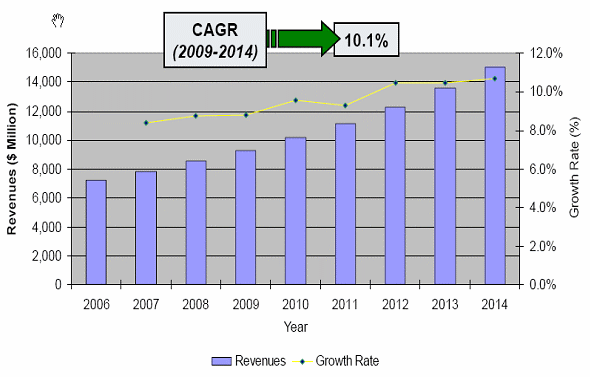
○ CMO 시장의 경우는 세계적인 약가인하 압력에 의해 생산비용을 절감하는 것이 중요한 경영전략상의 과제로 떠올랐을뿐만 아니나 신약개발 파이프라인의 감소 혹은 고갈, 특허만료로 인한 시장점유율의 하락에 따른 과잉 생산시설의 현실화 등으로 인해 수익성 악화에 직면한 글로벌 대기업(특히 머크나 화이저의 경우)들이 자체 양산시설을 폐쇄하고 전문위탁생산기업을 활용하는 경향이 증가함에 따라 성장하기 시작했다.
○ CMO의 경우는 비용경쟁이 점점 격화되고 있는데 이에 따라 각 CMO들은 부가서비스 제공에 주력하고 있다. 부가서비스로는 제품개발, 분석, 임상규제 지원, 컨설팅 서비스 등이 있으며 이를 통해 장기적인 파트너쉽을 통한 전략적인 상호이익을 추구하고 있다. 세계적으로 대표적인 CMO 기업으로는 Lonza, 베링거잉겔하임, Hospira, 셀트리온, Catalent, Patheon, DPT Lab, Pfizer, CentreSOurce, Baxter Biopharm Solutions, Hospira, One2One, Ben Venue Lab, DSM 등이 있다. 바이오의약 부문의 경우 론자, 베링거잉겔하임, 셀트리온 등 3개 내외가 전체 시장점유율의 40% 정도를 차지하고 있으며, 기타 나머지 40여개가 중소규모 임상시험용 위탁생산을 수행하는 등 이원화 된 경쟁구도를 형성하고 있다. 이들 CMO 시장은 최근 07-09년 사이에 연평균 성장률 13%를 기록하고 있으며, CRO시장과 마찬가지로 임상관련 컨설팅 제공 등 서비스 다변화, 서비스 종합화 경향이 강해지고 있다. 이는 단순히 CMO와 직접적인 관련을 가지는 지재권 보호, 낮은 위탁생산비용 등만으로는 격화되는 경쟁에서 살아남기 힘든 상황을 반영하는 것이기도 하다.
○ 그 중에서도 특히 성장성이 높은 지역은 중국과 인도인데, 중국의 경우 cGMP, GLP 등 국제적 수준의 규정에 걸맞는 시설과 운영프로세스를 준수하고 있으며 지난 2007년에는 무려 53개의 규제안을 신규 도입함으로써 미국 FDA가 중국에서 만들어진 모든 데이터를 신뢰, 수용하며, 이들 데이터를 기반으로 한다는 합의를 이끌어냈다. 이러한 제도개혁의 기반위에서 중국의 경우 줄기세포, 유전자 치료제 등 새롭게 떠오르고 있는 차세대 치료제 분야의 임상실험 및 생산시설을 구축함으로써 글로벌 바이오의약품 시장진입을 준비하고 있는데, 대표적인 사례가 RNAi Bank network, 줄기세포 치료전문병원 설립 등이 그것이다. 중국의 CRO시장은 2008년 2억 5천만 달러 규모에서 년성장 35%로 성장하여 2012년에는 7억 9천만 달러 규모로 성장할 것으로 예상되고 있다. 중국내에 존재하는 CRO 거점은 모두 300개로 해외수요 타겟형, 국내수요 타겟형, 그리고 벤처기업 타겟형으로 분류가능하다.
중국의 글로벌 임상대행전문기업
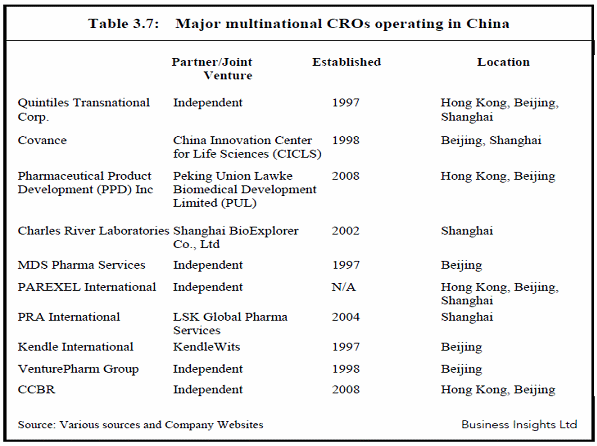
○ 중국의 CMO전문기업으로는 Zhejiang Hisun Pharmaceutical, Shanghai Pharmaceutical (Group), Shandong Xinhua Pharmaceutical, Tianjin Pharmaceutical이 있는데 이들 대부분은 설비용량이 국내수요보다 훨씬 커서 주력 타겟수요층이 해외 수요자로 맞추어져 있다. 중국은 이러한 경쟁에서 승리하기 위해 글로벌 차원의 전문가 영입에 집중하고 있다. 연구개발분야로는 중국정부가 주도하는 Shanghai Cell Engineering and Antibody Centre가 설립되어 암백신 등 최신 바이오의약품 생산역량을 구축하는데 노력을 경주하고 있다. Bayer Schering Pharma는 베이징에 1억4천만 달러를 투자해서 알앤디 연구소 설립 미국의 Pacific사는 CMO인 China Quatative Biomedicine과 디스포저블 생산시설(이 방면으로는 중국최대)을 이용한 생산계약 체결을 진행하고 있으며, 로슈사는 Chugai사와 협력관계를 체결해 지속해오고 있다.
중국의 주요 CMO기업
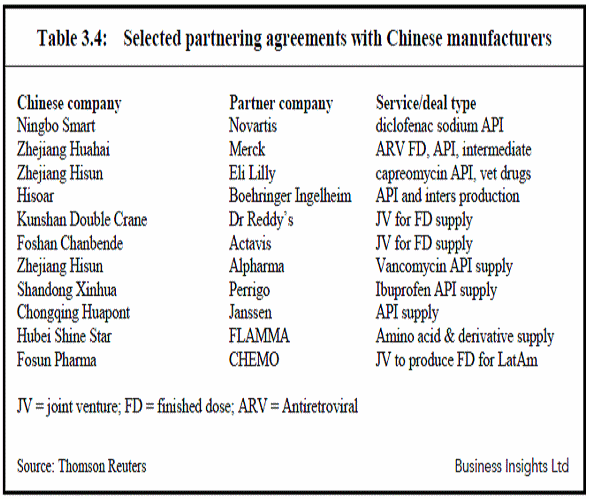
○ 인도의 바이오의약기업은 350여개로 그중에서 50%는 제품개발, 20%는 임상개발, 15%는 연구개발서비스, 그리고 5%는 플랫폼 기술에 집중하고 있다. 인도의 경우는 세계에서 가장 선호하는 의약품 아웃소싱 국가인데 미국 FDA에 의해 자격이 승인된 전문가 80여명과 미국을 제외한 전세계 생산시설 중 최고 수준의 규격인증을 받은 생산시설을 보유하고 있다. 인도는 이러한 위탁생산 분야의 경쟁력을 기반으로 전임상 분야의 연구역량과 시설을 강화하는 한편 생물학-화학 분야의 기초연구역량 강화에 주력하고 있다.
○ 특히 인도의 Biocon은 발효전문기업으로 바이오의약산업에 진출하였으며 최근 계약형 약물발굴과 임상시험 대행을 전문으로 하는 Syngene과 Clinigene를 각각 자회사로 설립하였으며 Reliance Life Science사는 바이오시밀러에 주력하고 있는 기업으로서 API 전문생산시설을 구축하고 있다. CMO회사인 Kemwell은 방갈로에 5천만 달러의 생산시설을 구축하고 있으며 CRO와 함께 CMO분야에 특화된 전략을 구사하고 있다. 인도에서 수행된 임상실험은 2009년 기준 총 50,600건, 4억 달러규모로서 2014년에는 8억 달러 규모로 성장할 것으로 예상된다(Business Insight, 2010). 이는 무엇보다 임상시험을 진행할 환자모집이 용이하고 미국에 비해 60% 이상 저렴한 임상시험 비용 때문으로 해석될 수 있다.
인도의 대표적인 CRO기업
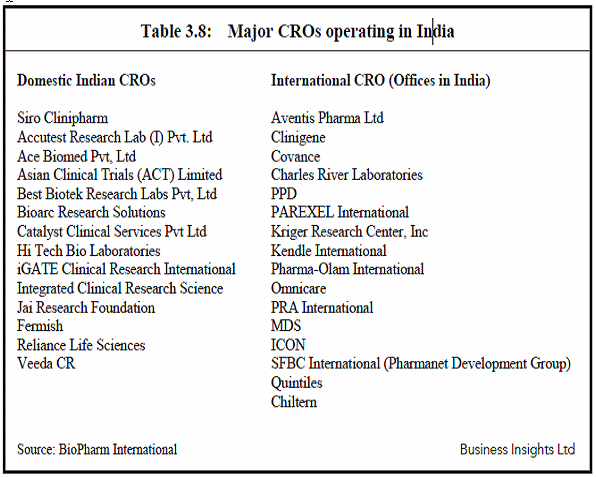
○ 브라질의 경우는 세계 7대 신흥시장 중 하나로서 위탁생산 및 위탁시험은 1996년부터 시작되었다. 2007년 현재 브라질에서 진행된 임상시험은 총 645건이며 주로 에이즈 관련 질환이나 전염성 질환과 박테리아 관련 질환에 특화하고자 하고 있다.
라틴아메리카 지역의 임상시험 대행 국가별 점유율
|