|
 이산화탄소 농도 규제 이산화탄소 농도 규제
이산화탄소는 주로 실내공기질 또는 환기상태의 척도로 사용되고 있으며, 실내공간에서 농도가 증가하면 호흡에 필요한 산소의 양이 부족하게 되어 일산화탄소와 함께 중요한 실내오염물질 중의 하나로 취급되고 있음.
이산화탄소는 사람의 호흡에 의해 주로 배출되고 연료의 연소시 발생되는 물질로서 미국의 경우는 실내 환기조건을 CO2를 기준으로 2,000ppm을 권장하고 있으나 우리나라와 일본의 경우는 1,000ppm을 기준으로 함.
우리나라에서 1,000ppm(0.1%)을 실내환경기준으로 설정한 이유는 1000ppm을 기점으로하여 인체의 대사작용이 일어나기 때문임(이산화탄소 농도가 1,000ppm이 되면 호흡운동을 증대하여 폐포내 환기를 증대하며, 폐포내의 이산화탄소량을 일정하게 유지하려 함)
 이산화탄소의 농도가 인체에 미치는 영향 이산화탄소의 농도가 인체에 미치는 영향
공기 중의 이산화탄소 농도가 4% 이상으로 상승하면 폐에서의 이산화탄소 배출이 장해가 된다.
이산화탄소 농도가 4 %까지는 인체에 위험한 영향은 없으나이산화탄소를 배출 시키기 위해 여유에너지(호흡수, 호흡량의 증가)를 사용하지 않으면 안된다.
4% 이상이 되면 공기중의 이산화탄소 농도가 높아져 체외로의 배출이 곤란해져 여러 가지 영향이 발생한다.
|
농도 |
증상 |
|
1% |
호흡속도가 소량 증가함 |
|
2% |
호흡속도가 평소보다 50% 정도 상승하며 지속적인 노출은 두통과 피로를 느끼는 원인이 됨 |
|
3% |
호흡 증대와 안면온감,일상 호흡속도보다 2배 빨라지고, 동작이 느려지며 난청/두통 및 심장박동과 혈압이 상승함 |
|
4-5% |
두통,충열,안면홍조,혈압상슴,눈귀 자극 호흡속도가 평소보다 4배 증가하며 중독증상이 나타나고 숨쉬기 힘들어 짐 |
|
6 % |
피부혈관의 확장, 구토 |
|
7-8% |
정신활동의 장애, 호흡곤란
-호흡이 매우 느려지며 두통, 시각 장애 및 판단력이 흐려지며 수 분내 의식불명이 될 수 있음 |
|
10%이상 |
무호흡, 무의식, 사망
질식으로 인한 사망사고가 발생할 수 있음 |
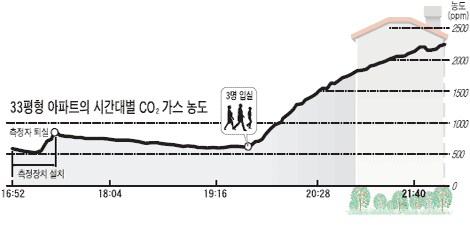
 취침중의 탄산가스 농도의 변화와 환기효과 취침중의 탄산가스 농도의 변화와 환기효과
|
취침중의 CO2 농도와 습도의 변화 |
30m3/h 기기환기의 효과 [8평, 2명 취침] |
|
|
|
|
- 콘크리트 아파트 8평에서 2명 취침
- 인체의 호흡만으로도 CO2는 500-3000PPM이
된다.
이산화탄소 농도의 실내 제한치는 1%(1000PPM)
이하이다.
| | |
이산화탄소란 ?
이산화탄소는 무색, 무취의 기체로 압력을 가하면 쉽게 액화된다. 이를 더 압축하면 고체상태인 드라이아이스를 만들 수 있는데, 상온, 상압에 드라이아이스를 놓아두면 승화되어 기체로 날아간다.
이산화탄소는 물에 약간 녹아 탄산이 되어 약한 산성용액을 만든다. 기체의 용해도는 압력을 높이고 온도를 낮출수록 올라가기 때문에 탄산음료를 만들 때는 낮은 온도와 높은 압력을 주어 이산화탄소를 녹인다. 탄산음료를 마셨을 때 따가운 느낌이 나는 것은, 물 속에 탄산의 형태로 녹아 있는 이산화탄소가, 낮은 압력과 높은 온도의 환경 때문에 용해도가 떨어져 기화되어 날아가면서 입 속을 자극하기 때문이다.
이산화탄소는 수산화칼슘과 반응하여 흰색의 앙금인 탄산칼슘을 만들기 때문에, 수산화칼슘을 물에 녹인 용액인 석회수에 이산화탄소를 통과시키면 용액이 뿌옇게 흐려진다. 그래서 이산화탄소를 검출하는 데에 석회수를 많이 이용한다.
이산화탄소는 공업적으로 석회석에 산을 가하거나 석회석을 가열하면 얻어진다. 알코올과 같은 탄소화합물이 연소할 때 물과 함께 생성되기도 하며 생물체가 유기물을 분해하는 과정에서도 만들어진다. 생명체는 호흡을 통해 유기물을 분해하면서 생활에 필요한 에너지를 얻는데, 이때 이산화탄소가 만들어지고 날숨을 통해 다시 공기 중으로 배출된다. 촛불을 끌 때 입김을 부는 이유가 바로 여기에 있다. 날숨에 들어 있는 다량의 이산화탄소가 초와 산소가 접촉하는 것을 방해해 더이상 연소가 진행되지 못하고 촛불이 꺼지는 것이다.
이산화탄소의 성질
무색·무취(無臭)의 기체로, 비중은 공기 1에 대하여 1.529, 승화점 -78.50℃이다. 상온(常溫)에서는 약간 비활성인 기체이나, 고온에서는 다른 물질과 반응하여, 예를 들면 알칼리 금속이나 알칼리 토금속에 의해 포름산이나 일산화탄소로 변한다. 또, 철 등과도 고온에서 반응하여 일산화탄소로 변하는 경우가 많다. 물에 잘 녹으며, 물 1ℓ에 대하여 0℃에서 1.71ℓ, 20℃에서 0.88ℓ, 40℃에서 0.53ℓ 녹는다. 물에 녹은 것을 탄산이라고 한다. 물 속에서는 일부 해리(解離)하여 산성을 띤다. 석회수 Ca(OH)2에 이산화탄소를 통하면 탄산칼슘 CaCO3를 생성하고 백색으로 탁해진다.
Ca(OH)2+CO2 → CaCO3+H2O
이산화탄소를 계속해서 통하면 중탄산칼슘 Ca(HCO3)2를 생성하여 녹고, 액체는 투명해진다.
CaCO3+CO2+H2O → Ca(HCO3)2
이것은 다른 기체에서는 볼 수 없는 특성이며, 종유동(鍾乳洞)의 종유석도 이 반응에 의해서 생긴다. 또, 수산화알칼리와 반응하여 탄산염을 생성한다.
(네이버 백과사전 참조)
▶ 혈액을 통해서 산소를 세포로 전달하고, 세포에서 배출된 이산화탄소를 다시 혈액을 통해서 폐로 이동시킨 다음에 배출하게 됩니다. 이런 과정에 대해서 알아보기로 합니다.
http://www.youtube.com/watch?v=x26TWL3VKMg&NR=1
1) 산소의 이동
사실 산소의 이동은 별로 복잡하지 않습니다. 우리가 자주 듣는 말이 있습니다. 헤모글로빈(Hb)이라는 것을 통해서 대부분 이동하게 됩니다. 산소는 일단 물에 잘 녹지 않는 성질이 있어서 기본적으로 그냥 혈액에 녹는 양은 거의 없습니다. 1%도 안되는 양이 혈액에 녹아서 이동하게 되고 대부분은 헤모글로빈이라는 단백질에 결합해서 이동하게 됩니다. 아마도 빈혈 약을 선전할 때 많이 들었을 것입니다. 이 헤모글로빈에는 철분이 포함되어 있어서 철분이 있어야지만 헤모글로빈이 만들어집니다.(이것은 좀 벗어난 이야기이고...)
산소는 헤모글로빈과 결합해서 목적지까지 이동하게 되는 것입니다. 결국 헤모글로빈이 없다면 산소를 세포에 공급할 수가 없는 셈이지요...
그럼 공부하는 김에 좀 더 공부를 하는 것이 좋을 것 같습니다. 아마도 몇 년 전에만 하더라도 연탄가스 중독이라는 것을 신문에서 볼 수 있었습니다. 이 연탄 가스 중독이 헤모글로빈과 많은 연관성을 지닙니다. 연탄가스라고 하는 것은 일산화탄소(CO)로 헤모글로빈과 결합을 무지하게 잘 합니다. 그래서 한 번 결합하면 떨어지지 않기 때문에 일산화탄소가 결합한 헤모글로빈은 산소를 운반할 수 없게 됩니다. 그러면 당연히 세포에 산소가 공급이 되지 않기 때문에 세포는 숨을 쉴 수가 없게 되는 것이지요(세포 호흡이 제대로 이루어지지 않는 것입니다...) 결국 세포들이 모두... 맛이 가는 것입니다...
실제로 산소와 헤모글로빈의 결합에 대해서는 좀 더 복잡한 부분도 있고 자세히 알려고 하면 어려운 부분도 많이 있기는 하지만, 그 정도까지 알 필요는 없을 것 같습니다. 일단, 이 정도만 알고 있으면 앞으로 언급하는 내용에 대한 이해는 별 문제가 없을 것 같습니다.
2) 이산화탄소의 이동
이산화탄소의 이동은 만만하지 않습니다. 세포에서 만들어진 이산화탄소는 몇 가지 방식을 통해서 이동을 하고 실제로 여러 부분과 연관되기 때문에 자세히 알아두어야 합니다. 그럼 일단 시작하겠습니다.
① 일단 이산화탄소는 물에 잘 녹습니다. 그러니까 탄산음료들이 마구 쏟아져 나오는 것이겠지요...(잘 녹지도 않으면 만들기도 힘든데 누가 생산을 합니까? 또 딴 이야기를...^^;) 그래서 이런 식으로 물에 녹아서 이동하는 이산화탄소가 전체의 10%정도가 됩니다.
② 그리고, 역시 헤모글로빈과 결합해서 이동하는 놈들도 있습니다. 이런 녀석들이 약 20%정도가 됩니다.
③ 그럼 나머지 70%는 어떤 형태로 이동을 할까요? 이 놈들이 중요합니다. 나중에 다시 언급하겠지만. 산-염기 대사에서 엄청 중요한 위치를 차지하는 놈들로 중탄산염(HCO3-)의 형태로 이동을 합니다. 이 녀석들이 어떻게 만들어지는지 보도록 하겠습니다.
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3-
물과 결합한 이산화탄소는 효소에 의해서 수소이온과 중탄산염으로 분리가 됩니다. 물론 이런 반응은 가역적으로 일어날 수 있습니다. 이산화탄소가 많으면 중탄산염과 수소이온이 늘어나는 방향으로 반응이 진행되고, 이산화 탄소가 없는 경우라면 반대 방향(수소 이온과 중탄산염이 줄어드는 방향)으로 반응이 진행하게 됩니다. 그리고 이런 반응은 적혈구 내에서 이루어지게 됩니다.
여기서 눈 여겨 볼 것이 있습니다. 바로 수소 이온이지요... 이 놈이 바로 우리 신체의 산-염기 균형을 조절하는 중요한 부분이 됩니다. 이 수소 이온이 많으면 신체가 산성이 되고, 이 수소 이온이 줄어들면 신체가 염기가 되는 것이지요... 일단은 이 정도만 알아두고 넘어가기로 하지요...^^ 산-염기 균형 및 대사에서 다시 언급할 내용이니까요...
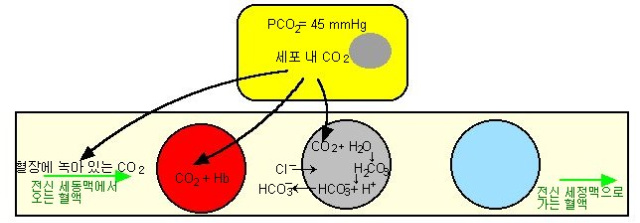
세포에서 만들어진 이산화탄소를 혈액을 통해서 이동하는 방식을 그림으로 정리한 것입니다. 역시 모세혈관과 세포사이에서 이루어지는 이산화탄소의 교환을 그림으로 정리한 것입니다. 혈장에 녹는 이산화탄소, 헤모글로빈과 결합하는 이산화탄소, 중탄산염으로 전환되는 이산화탄소의 모습을 그림으로 정리한 것입니다.
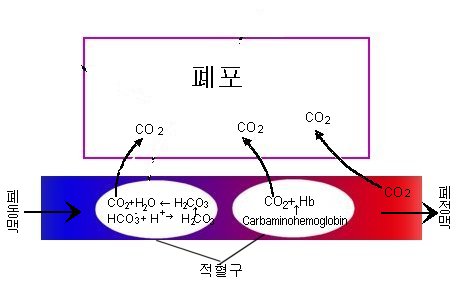
세포에서 배출된 이산화탄소를 혈액을 통해서 폐로 가져온 다음에 폐포로 배출하는 모습입니다. 헤모글로빈에 결합한 이산화탄소는 바로 분리되어서 배출되고, 혈액 속에 녹아있던 이산화탄소도 농도차이에 의해서 폐포로 이동하게 됩니다.
그리고, 중탄산염은 다시 이산화탄소로 전환되어서 배출됩니다.(반응이 가역적이기 때문에 다시 이산화탄소로 변합니다... 폐에는 이산화탄소의 농도가 낮으니까...^^)
http://search.pandora.tv/frame/outSearch.htm?ref=na&ch_userid=clubwise&id=9274032&keyword=%BB%EA%BC%D2
|