<p><span style="font-size: 11pt;">beyond reason</span><br></p><p><span style="font-size: 11pt;"><br></span></p><p><span style="font-size: 15px; line-height: 23px;">인슐린 저항성</span></p><p><span style="font-size: 15px; line-height: 23px;">당뇨, 고혈압, 고지혈증, 비만.. 대사증후군과 인슐린 저항성</span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><span style="font-size: 15px; line-height: 23px;">설탕, 단순포도당을 자주 많이 섭취하면&nbsp;</span></p><p><span style="font-size: 15px; line-height: 23px;">인슐린이 자주 분비되고&nbsp;</span></p><p><span style="font-size: 15px; line-height: 23px;">몸의 조직(세포)는 과도한 인슐린을 쓰지 않는 상황이 발생</span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><span style="font-size: 15px; line-height: 23px;">인슐린 저항성 높아짐&nbsp;</span></p><p><span style="font-size: 15px; line-height: 23px;">- 인슐린 수치는 높고 --&gt; 지방저장호르몬 인슐린은 지방을 저장하고</span></p><p><span style="font-size: 15px; line-height: 23px;">- 세포는 인슐린을 사용하지 않고</span></p><p><span style="font-size: 15px; line-height: 23px;">- 포도당은 남아돌고</span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><span style="font-size: 15px; line-height: 23px;"><b>인슐린 저항성을 정상화시키기</b></span></p><p><span style="font-size: 15px; line-height: 23px;"><b><span style="color: rgb(9, 0, 255);">1) 단순당 섭취 횟수, 양 줄이기</span></b></span></p><p><span style="font-size: 15px; line-height: 23px;"><b><span style="color: rgb(9, 0, 255);">2) 섬유소 섭취 양 늘리기</span></b></span></p><p><span style="font-size: 15px; line-height: 23px;"><b><span style="color: rgb(9, 0, 255);">3) 유산소, 근력운동으로 인슐린 사용능력 증가시키기</span></b></span></p><p><span style="font-size: 15px; line-height: 23px;"><b><span style="color: rgb(9, 0, 255);">4) 간헐적 단식하기&nbsp;</span></b></span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><span style="font-size: 15px; line-height: 23px;">포도당을 에너지로 사용하는 몸을 지방산을 에너지로 사용하는 몸으로 만들기</span></p><p><span style="font-size: 15px; line-height: 23px;">- 저탄고지 식사</span></p><p><span style="font-size: 15px; line-height: 23px;">- 소변에서 케톤체 검사</span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><br></p><p style="text-align: center;"><img src="https://t1.daumcdn.net/cfile/cafe/99E1B34E5D358A2B23" class="txc-image" actualwidth="777" hspace="1" vspace="1" border="0" width="777" exif="{}" data-filename="스크린샷 2019-07-22 오후 7.02.39.png" style="clear:none;float:none;" id="A_99E1B34E5D358A2B2300E4"/></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p>
</p><div class="page" title="Page 1">
<div class="layoutArea">
<div class="column">
<p><span style="font-size: 11.000000pt; font-family: 'YDIYGO130-KSCpc-EUC-H'"><b>인슐린저항성(Insulin resistance)이란?
</b></span></p>
<p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인슐린은 <b><span style="color: rgb(255, 0, 0);">당질</span></b></span><span style="font-size: 11pt; font-family: TimesNewRoman;"><b><span style="color: rgb(255, 0, 0);">, </span></b></span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">지질 및 단백질 등 에너지대사를 총체적</span><span style="color: rgb(255, 0, 0);">으로 조절하는 가장 중요한 생체호르몬</span></b>으로 성장 및 전해질</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(potassium) </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">조절에도 관여하는데 <b><span style="color: rgb(255, 0, 0);">인슐린저항성</span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(insulin resistance)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">은 생리적 인슐린농도에서 이러한 인슐린작용</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">인슐린
감수성</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">: insulin sensitivity)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">이 정상보다 저하된 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">metabolic state</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">로 정의할 수 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그러나 생체에서 인슐린저항성을 정확히
간략하게 정의하기는 쉽지 않다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인슐린저항성상태라도 모든 인슐린작용이 동시에 같은 정도로 감소하는 것도 아니고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">,
</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">신장에서 염분저류및 간에서의 지방산 신합성과 같은 기능은 저하되지 않고 인슐린저항성에 동반되는 고인슐린혈증에 의해 오히려 증가됨으로 인슐린저항성관련 대사질환의
병인에는 인슐린작용 중 저하된 기능과 고인슐린혈증에 의해 증가되는 기능이 모두 함께 관여하는 것으로 이해되고
있기때문이다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그러나 <b><span style="color: rgb(9, 0, 255);">인슐린작용중 당질및 지질대사에
대한 작용이 감소된 상태가 대사성질환의 발병과 깊은 연관</span><span style="color: rgb(9, 0, 255);">성을 나타내고 비만 및 고지방식이에 의한 인슐린저항성 초</span><span style="color: rgb(9, 0, 255);">기부터 관찰됨으로 이를 일반적으로 인슐린저항성</span></b>이라 한다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">1-3)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">좀더 구체적으로 <b><span style="color: rgb(255, 0, 0);">인슐린은 췌장 베타세포에서 식후
분비되어 근육으로 포도당섭취</span></b></span><span style="font-size: 11pt; font-family: TimesNewRoman;"><b><span style="color: rgb(255, 0, 0);">(glucose uptake)</span></b></span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">를 촉진</span></b>하거</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">나 <b><span style="color: rgb(255, 0, 0);">간에서 포도당생성</span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(hepatic glucose output, HGO)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">을 억제하여 혈당을 조절하고</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">지방조직에서 지방산분해</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(lipolysis)</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">를
억제하여 섭취된 에너지를 저장</span></b>하는데 인슐린 저항성은 인
슐린이 부족하지 않은 상태에서 이러한 인슐린 작용이 감소된 상태를 의미한다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">1-3)</span><span style="font-size: 9pt; line-height: 1.6; font-family: TimesNewRoman;"><span style="font-size: 11pt;">.</span></span></p></div><div class="column"><p><span style="font-size: 9.000000pt; font-family: 'TimesNewRoman'"><br></span></p>
<p><span style="font-size: 11.000000pt; font-family: 'YDIYGO130-KSCpc-EUC-H'"><b>당질대사에 있어서 인슐린 작용
(Insulin actions on glucose metabolism)
</b></span></p>
<p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">공복상태에서 체내 포도당 이용의 약 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">50%</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">는 뇌에서 사용되는데 이를 위해 <b><span style="color: rgb(255, 0, 0);">혈당은 주로 간의 포도당생성</span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(HGO)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><span style="color: rgb(255, 0, 0);">에 의</span><span style="color: rgb(255, 0, 0);">해 유지되며</span></span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">포도당생성은 간에 저장된 당원이 분해</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(glycogenolysis)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">되거나 포도당신생</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(gluconeogenesis)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">에 의해 유지된다</span></b><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">1-4)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.<b><span style="color: rgb(9, 0, 255);"> 6~12</span></b></span><b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">시간의 공복까지는 당원분해</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(glycogenolysis)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">와 포도당신생과정</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(gluconeogenesis)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">이 포도당생성에 각각 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">50% </span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">정</span><span style="color: rgb(9, 0, 255);">도 관여되나 공복시간이 길어지면 포도당신생과정이 포도당
생성에 더욱 중요한 역할</span></b>을 한다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">1-4)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span></p><p><br></p><p style="text-align: center;"><img src="https://t1.daumcdn.net/cfile/cafe/99686B485D358FF126" class="txc-image" actualwidth="452" hspace="1" vspace="1" border="0" width="452" exif="{}" data-filename="스크린샷 2019-07-22 오후 7.28.27.png" style="clear:none;float:none;" id="A_99686B485D358FF126B90A"/></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><br></p><p style="text-align: center;"><img src="https://t1.daumcdn.net/cfile/cafe/9924BB4D5D35905209" class="txc-image" actualwidth="844" hspace="1" vspace="1" border="0" width="844" exif="{}" data-filename="스크린샷 2019-07-22 오후 7.30.17.png" style="clear:none;float:none;" id="A_9924BB4D5D35905209B775"/></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">한편 <b><span style="color: rgb(255, 0, 0);">식후 소화관에서
음식물로부터 흡수된 포도당에 의해 혈당이 증가하면 췌장
</span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">β</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">세포에서 인슐린이 분비되고</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">분비된 인슐린은 근육으로
포도당의 흡수</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(muscle glucose uptake)</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">를 촉진</span></b>한다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 인슐린은 간의 포도당흡수에도 일부 관여하지만 주로 간의 <span style="font-size: 11pt;">포</span></span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">도당생성을 억제한다</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서 <b><span style="color: rgb(9, 0, 255);">인슐린은 간에서 포도당생성</span><span style="color: rgb(9, 0, 255);">을 억제하고 근육을 포함한 말초조직으로 포도당흡수를 촉
진하여 혈중 포도당 농도를 낮춘다</span></b></span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">(</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">그림 </span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">1).&nbsp;</span></p><p><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;"><br></span></p><p><br></p><p style="text-align: center;"><img src="https://t1.daumcdn.net/cfile/cafe/99BF52505D358ECB2D" class="txc-image" actualwidth="429" hspace="1" vspace="1" border="0" width="429" exif="{}" data-filename="스크린샷 2019-07-22 오후 7.23.37.png" style="clear:none;float:none;" id="A_99BF52505D358ECB2D19BF"/></p><p><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;"><br></span></p><p><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><b><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">간과 근육으로
흡수된 포도당의 대부분은 당원으로 저장되거나 해당작용</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(glycolysis)</span></b><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">을 거쳐 대사</span></b>된다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">1-4)</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">.&nbsp;</span><b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">말초조직의 세포 내 포도당흡수의 속도조절단계는 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">glucose
transporter 4 (GLUT4)</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">에 의한 세포 내 포도당 유입과정이며
이 과정은 인슐린신호전달계에 의해 주로 조절</span></b>된다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">5)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인슐린수용체</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(insulin receptor)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 인슐린이 결합한 후 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">docking protein</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">insulin receptor substrate 1, 2 (IRS1, IRS2)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">tyrosine </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인산화가 증가하고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이어서 인산화된 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">IRSs</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">SH2 domain</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">을 가지는 단백질</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(PI3K, Grb2, SHP2 </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">등</span><span style="font-size: 11pt; font-family: TimesNewRoman;">)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이 결합하여 활성화된다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">6)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.
</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">근육에서는 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">PI3K</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 의해 활성화된 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">Akt</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">와 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">aPKCs</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 의해
</span><span style="font-size: 11pt; font-family: TimesNewRoman;">GLUT4</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">가 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">cytoplasmic pool</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에서 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">plasma membrane</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">으로 이동하여 인슐린자극에 의한 포도당 유입을 매개하고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">간에서는
</span><span style="font-size: 11pt; font-family: TimesNewRoman;">PI3K</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 의해 활성화된 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">Akt</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 의해 당원분해와 포도당신생을
억제하여 포도당의 생성을 억제하는 것으로 알려져 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">6)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">대표적인 인슐린 감수성 조직은 근육</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">간 및 지방조직인데</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">,
</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><span style="color: rgb(9, 0, 255);">인슐린작용에 의한 포도당 대사는 정량적인 면에서 주로 근</span><span style="color: rgb(9, 0, 255);">육과 간에서 일어난다</span></span></b><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">1)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서 근육과 간의 포도당 대사의
직접적인 변화없이는 전신의 포도당 대사에서 정량적으로
영향을 주기는 어려우므로 <b><span style="color: rgb(255, 0, 0);">근육 및 간의 인슐린저항성이 전</span><span style="color: rgb(255, 0, 0);">신의 인슐린저항성을 정량적으로 결정한다</span></b>고 할 수 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 <b><span style="color: rgb(9, 0, 255);">인슐린은 지방조직에서 지방분해를 억제하고 간 및 지방
조직에서 지방산신합성</span></b></span><span style="font-size: 11pt; font-family: TimesNewRoman;"><b><span style="color: rgb(9, 0, 255);">(de novo lipogenesis)</span></b></span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">을 촉진</span></b>한다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.</span></p><div class="page" title="Page 2"><div class="layoutArea"><div class="column"><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;"><b>인슐린저항성과 제2형 당뇨병 및
대사증후군과의 관계
</b></span></p><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인슐린저항성은 제</span><span style="font-size: 11pt; font-family: TimesNewRoman;">2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">형 당뇨병의 병인연구로 개념 및 기전연구가 시작되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">제</span><span style="font-size: 11pt; font-family: TimesNewRoman;">2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">형 당뇨병은 고혈당을 공통적 <span style="font-size: 11pt;">요</span></span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">소로 보이지만 많은 다양한 원인에 의한 질환군이다</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">.&nbsp;</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">이중
제</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">2</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">형 당뇨병의 발생과 가장 밀접한 관계를 보이는 비만 및
고지방식이에 의한 내당능장애 환자에서 흔히 발견되는 인슐린저항성의 경우 췌장베타세포에서 인슐린 분비능이 보상적으로 증가</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">(hyperinsulinemia)</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">되어 있는 상태에서는 정상혈당을 유지하지만 인슐린 분비능이 인슐린저항성을 극복할
수 없을 경우 혈당의 상승과 함께 제</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">2</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">형 당뇨병이 발생하는
것으로 이해되고 있다</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">.&nbsp;</span></p><p><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">즉</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">인슐린저항성은 제</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">2</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">형 당뇨병 환자의 대부분에서 특징적이고 공통적으로 관찰되며</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">1-3)</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">제</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">2</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">형
당뇨병 환자의 당뇨병이 발병하지 않은 자식에서 이미 인슐린저항성을 보이는 경우가 있고</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">7)</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">, </span><b><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">전향적 연구에서 인슐린
저항성이 제</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman; color: rgb(9, 0, 255);">2</span></b><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">형 당뇨병 발생의 가장 강력한 예측인자</span></b>이며</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">8)</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">,
</span><b><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;"><span style="color: rgb(255, 0, 0);">인슐린저항성을 호전시킴으로 당뇨병 발병을 예방할 수 있</span><span style="color: rgb(255, 0, 0);">다는 연구결과</span></span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt; color: rgb(255, 0, 0);">9)</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">를 근거로 제</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman; color: rgb(255, 0, 0);">2</span></b><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">형 당뇨병의 대부분을 차지하
는 비만 및 고지방식이 관련 당뇨병에서는 일반적으로 인슐린저항성이 선행하는 일차적인 원인으로 생각</span></b>되고 있다</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 <b><span style="color: rgb(9, 0, 255);">인슐린저항성에 대해 보상적으로 인슐린 분비능이 증가</span><span style="color: rgb(9, 0, 255);">되는 내당능장애 상태에도 혈당의 상승을 억제하여 당뇨병
발생은 억제하지만 다른 심혈관 질환의 발생위험을 증가시</span><span style="color: rgb(9, 0, 255);">키므로 인슐린저항성은 제</span></b></span><b><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman; color: rgb(9, 0, 255);">2</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">형 당뇨병의 가장 중요한 선행요인인 동시에 대사증후군</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(metabolic syndrome) </span></b><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">발생의 핵심인자</span></b>로 생각되고 있다</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">(</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">그림 </span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">2)</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">10-13)</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">대사증후군은 각각의 질환을 단일질병으로 생각하지 않고</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">,&nbsp;</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">공통적인 원인에 의해 발병할 수 있는 하나의 질환군으로 묶어서 생각하는 개념이지만 대<b><span style="color: rgb(255, 0, 0);">사증후군의 구성요소도 다양하며 새로운 요소들이 지</span><span style="color: rgb(255, 0, 0);">속적으로 밝혀지고 있어 대사증후군의 병인을 한</span><span style="color: rgb(255, 0, 0);">가지 요</span><span style="color: rgb(255, 0, 0);">인으로 설명하기란 쉽지 않다</span></b></span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">그러나 인슐린저항성은 대사성증후군의 구성요소 중 가장 흔히 발견되고 또 대부분</span><span style="font-family: YDIYMjO120-KSCpc-EUC-H; font-size: 11pt; line-height: 1.6;">의 다른 요소의 발생과 기전적으로 밀접한 상관관계를 보여 비만과 함께 대사성증후군의 근본적인 원인으로 제시되</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; vertical-align: -5pt;">고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">10-13)</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: -5pt;">.</span></p><p><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: -5pt;"><br></span></p><div class="page" title="Page 3"><div class="layoutArea"><div class="column"><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">인슐린저항성이 대사증후군의 이상지질혈증 및 고혈압발</span><span style="color: rgb(9, 0, 255);">생에 관여하는 기전을 요약</span></b>하면 <b><span style="color: rgb(255, 0, 0);">인슐린저항성 및 그와 동반</span><span style="color: rgb(255, 0, 0);">되는 고인슐린혈증 상태에서 지방조직에서 유리지방산의 분</span><span style="color: rgb(255, 0, 0);">해가 상대적으로 증가되어 간으로 유리지방산의 유입이 증</span><span style="color: rgb(255, 0, 0);">가되면 간에서 지방합성 및 </span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">Very Low Density Lipoprotein
(VLDL)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">의 생성이 증가되고 또한 지방조직에서 </span><span style="font-size: 11pt; font-family: TimesNewRoman;"><span style="color: rgb(255, 0, 0);">lipoprotein li</span><span style="color: rgb(255, 0, 0);">pase</span></span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">를 활성화시키는 인슐린의 작용에 저항성이 생겨 혈중
중성지방이 증가될 수 있다</span></b><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">혈중 중성지방의 증가에 의한
</span><span style="font-size: 11pt; font-family: TimesNewRoman;">cholesterol ester transfer protein</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 활성화로 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">HDL</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">과 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">LDL</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에서
</span><span style="font-size: 11pt; font-family: TimesNewRoman;">VLDL</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">로 콜레스테롤이 이동하고 역으로 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">VLDL</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 중성지방은 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">HDL</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">과 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">LDL</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">로 이동하여 중성지방이 많아진 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">HDL </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">및
</span><span style="font-size: 11pt; font-family: TimesNewRoman;">LDL</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이 생기고 이들은 또 다른 중성지방 분해효소인 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">hepatic
lipase</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 작용에 의해 분해되거나 작아져 혈중 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">HDL-C </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">농도는 감소하고 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">small dense LDL </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">등은 증가하는 것으로 설명할
수 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">13)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 <b><span style="color: rgb(255, 0, 0);">인슐린저항성은 교감신경계의 활성화 및 인슐린에 의한 혈관내피세포의 </span></b></span><span style="font-size: 11pt; font-family: TimesNewRoman;"><b><span style="color: rgb(255, 0, 0);">Nitric Oxide </span></b></span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">생성의 장애와 밀</span><span style="color: rgb(255, 0, 0);">접한 관계</span></b>를 보이고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">고인슐린혈증은 신장에서 염분 저류 및
세포내 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">free cytosolic Ca</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt; color: rgb(9, 0, 255);">2+ </span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">농도를 증가시켜 고혈압발생에 관여하는 것으로 생각</span></b>되고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">13)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.
</span></p><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;"><br></span></p><p><b><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;">인슐린저항성 발생기전&nbsp;</span></b></p><p><b><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;"><br></span></b></p><p><b><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;">1. 조직의 지방축적과 인슐린저항성
</span></b></p><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">최근 <b><span style="color: rgb(9, 0, 255);">폭발적인 증가를 보이는 제</span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><span style="color: rgb(9, 0, 255);">형 당뇨병 및 대사증후</span><span style="color: rgb(9, 0, 255);">군은 비만인구의 증가와 밀접한 상관관계를 보이며 인슐린
저항성을 특징적으로 나타낸다</span></span></b><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그러나 <b><span style="color: rgb(255, 0, 0);">지방조직의 분화장</span><span style="color: rgb(255, 0, 0);">애에 의해 지방조직의 절대적 감소를 보이는 </span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">lipodystrophy
</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">환자 및 마우스 모델에서 비만과 반대의 형질</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(phenotype)</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">을
보이지만 전신비만 환자보다도 심한 인슐린저항성</span></b>을 보인다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">3,14)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이는 에너지를 지방으로 축적할 수 있는 지방조직의
절대적 부족으로 섭취된 에너지가 포도당 대사에 정량적으로 중요한 간과 근육에 지방으로 저장됨으로써 더욱 심한
인슐린저항성이 나타난다고 보고되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">3,14)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. lipodystrophy </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">마우스 모델에 지방조직을 이식한 경우</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">15)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">와 식이조절에 의해
식사량을 감소시킨 비만환자 연구</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">16)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에서 간과 근육의 지방
축적이 감소되었고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">더불어 인슐린저항성이 현저히 호전되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 근육과 간에 특이적인 지단백질 분해효소</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(lipoprotein lipase, LPL) </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">과발현마우스에서 이들 장기에 선택적으</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">로 지방축적을 유도하였을 때 이들 조직에 인슐린저항성이
나타났으며</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">17)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">근육 특이적인 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">LPL knock-out (KO)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">마우스에서는 근육의 지방축적을 예방하여 고지방식이에 의한 인슐린저항성을 현저히 호전시켰다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">18)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 <b><span style="color: rgb(255, 0, 0);">핵자기공명분광기법</span><span style="color: rgb(255, 0, 0);">으로 근육에 축적된 지방중 세포내와 세포외의 지방을 정</span><span style="color: rgb(255, 0, 0);">량적으로 측정하면 세포 내 지방축적이 인슐린저항성과 가</span><span style="color: rgb(255, 0, 0);">장 밀접한 관계</span></b>를 나타낸다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">19)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이러한 결과는 <b><span style="color: rgb(9, 0, 255);">비만에 의한
인슐린저항성의 발생은 전신비만보다는 포도당대사에 중요</span><span style="color: rgb(9, 0, 255);">한 근육과 간의 지방축적이 직접적인 원인이며 조직에 축적</span><span style="color: rgb(9, 0, 255);">된 지방중 세포내 지방축적이 더욱 중요한 요인임을 시사</span></b>한다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그림 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">3).</span></p><p><span style="font-size: 11pt; font-family: TimesNewRoman;"><br></span></p></div><div class="column"><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">근육 및 간에 축적된 지방 중 대부분을 차지하는 중성지방은 화학적으로 비활성형태를 취하고 또 중성지방합성의
마지막 단계인 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">diacylglycerol acyltransferase 1 (DGAT1)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">을 근육과 간에 과발현시켰을 때 중성지방은 증가하지만 인슐린
저항성과는 상관관계를 나타내지 않아 <b><span style="color: rgb(9, 0, 255);">축적된 지방 중 대부</span><span style="color: rgb(9, 0, 255);">분을 차지하는 중성지방보다는 생리활성</span><span style="color: rgb(9, 0, 255);">물질로서 역할을
하는 지질대사체가 인슐린신호전달계를 억제하여 인슐린저</span><span style="color: rgb(9, 0, 255);">항성의 발생에 관여하는 것으로 생각</span></b>되고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">3,20-22)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이러한
지질대사체로는 중성지방 경로의 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">long-chain acyl CoA, Lyso-
phosphatidic acid, Phosphatidic acid, Diacylglycerol (DAG)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">과
스핑고지질계의 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">Ceramide </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">및 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">GM3, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인지질 경로의 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">lysophos-
phatidylcholine </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">등이 거론되고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">20-22)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그 외에도 많은 생리활성 지질대사체가 존재함으로 새로운 지질대사체가 인슐린
저항성 발생을 유도할 가능성은 충분하다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이 중 <b><span style="color: rgb(9, 0, 255);">가장 많이
연구된 가설로 조직에서 유리지방산의 이용 증가로 근육과
간의 </span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">Diacylglycerol</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">이 증가하고 이것이 이들 조직의 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">novel
PKCs (</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">근육</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">: PKC</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">θ</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">간</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">: PKC</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">ε</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">), c-Jun-N-terminal kinase (JNK),
IkB kinase-</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">β </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(IKK-</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">β</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">) </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">등을 활성화시키고</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">활성화된 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">serine/
threonine kinases</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">에 의해 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">IRS1 &amp; 2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">의 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">serine phosphorylation</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">이
증가하고 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">tyrosine phosphorylation</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">은 감소하여 <span style="color: rgb(255, 0, 0);">결국 </span></span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">PI3K </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">및
</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">Akt</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">의 활성을 감소시키므로서 근육에서는 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">GLUT4</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);"><span style="color: rgb(255, 0, 0);">에 매개되</span><span style="color: rgb(255, 0, 0);">는 포도당 유입이 감소되고 간에서는 </span></span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">HGO</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">가 억제되지 않아
인슐린저항성이 발생한다는 가설이 제시</span></b>되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">3,20)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 세포막을 구성하는 대표적인 지질성분 중 하나인 세라마이드는 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">palmitic acid</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">로부터 새로이 합성될 뿐만 아니라 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">inflammation</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 동반되어 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">TNF</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 의해 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">sphingomyelinase</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">가 활성화되어 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">sphingomyeline</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에서도 생성되어 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">protein phosphatase 2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">를 활성화하여 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">Akt dephosphorylation</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">을 촉진하고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, JNK1</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">및 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">IKK</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">를
활성화하여 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">IRS1 &amp; 2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">serine phosphorylation</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">을 증가시켜 포화지방산</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, TNF</span><span style="font-size: 11pt; font-family: TimesNewRoman;">α </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">및 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">glucocorticoid</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">에 의한 인슐린저항성을<span style="font-size: 11pt;"> 매</span></span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">개하는 것으로 알려지고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">21,23,24)</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">.</span></p><p><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;"><br></span></p><span style="font-size: 11pt;">
</span><span style="font-size: 11pt;">
</span><div class="page" title="Page 4"><span style="font-size: 11pt;">
</span><div class="layoutArea"><span style="font-size: 11pt;">
</span><div class="column"><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">비만 및 고지방식이에서 간과 근육의 세포 내 지방축적은&nbsp;</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">지방산 섭취</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">유입</span><span style="font-size: 11pt; font-family: TimesNewRoman;">), </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">합성의 증가 및 지방산 산화의 감소에 의해 결정될수 있으나</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">지방축적에 대한 이들 세가지 경로의
중요도는 생리적 조건과 조직마다 다른 영향을 나타내는데</span><span style="font-size: 11pt; font-family: TimesNewRoman;">,
</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">예를 들어 전신 비만 및 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">lipodystrophy </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">환자에서는 간과 근육에 지방유입 및 합성의 증가에 의해서 지방축적이 증가한다면</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">16)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">비만하지 않은 노인 및 인슐린저항성 환자에서는 미토콘드리아에서 지방산 산화의 감소가 지방축적의 주된 원인일 가능성이 제시되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">25,26)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.</span></p><p><span style="font-size: 11pt; font-family: TimesNewRoman;"><br></span></p><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;"><b>2. 염증반응(Inflammation) 가설
</b></span></p><span style="font-size: 11pt;">
</span><p><b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">비만 및 고지방식이 섭취 시간</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">근육조직의 지방축적과
함께 지방조직</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">(adipose tissue)</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">의 염증반응이 동반</span></b>된다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">비만
과정에서 지방조직을 중심으로 대식세포</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(macrophage)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><span style="color: rgb(9, 0, 255);">가 침</span><span style="color: rgb(9, 0, 255);">착하고</span></span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(9, 0, 255);">활성화된 대식세포와 지방세포에서 </span><span style="font-size: 11pt; font-family: TimesNewRoman;"><span style="color: rgb(9, 0, 255);">inflammatory cy</span><span style="color: rgb(9, 0, 255);">tokine</span></span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">의 분비가 증가하여 비만에 동반된 인슐린저항성을 유</span><span style="color: rgb(9, 0, 255);">발한다는 가설이 제기</span></b>되고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">27,28)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그러나 이러한 기전에
의해 인슐린저항성이 유발되기 위해서는 비만조직으로부터
생성된 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">inflammatory cytokine</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이 포도당대사에 정량적으로 중요한 간과 근육까지 고농도로 도달하여야 가능하다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">왜냐하면 지방조직의 포도당 섭취율은 근육에 비해 약 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">20</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">분이 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">1</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">수준으로 지방조직의 국소 염증반응으로 지방조직에 대한 인</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">슐린저항성이 발생하여 포도당섭취가 감소하여도 간과 근육에서 포도당 대사에 영향이 없으면 전신의 인슐린저항성 및
포도당대사에 정량적으로 영향을 주기 어렵기 때문이다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그러나 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">TNF</span><span style="font-size: 11pt; font-family: TimesNewRoman;">α</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">나 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">IL-6 </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">등 대표적인 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">inflammatory cytokine</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">은 인슐
린저항성을 보이는 사람 및 동물모델의 혈액에서 혈중 농도의 증가를 보이는 경우가 드물고</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">29-31)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이러한 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">inflammatory
cytokine</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">을 고농도로 주입한 실험에서만 간의 인슐린저항성이 발생한다는 보고</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">32)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">가 있어 지방조직의 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">inflammation</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이 생리적 조건에서도 간과 근육의 인슐린저항성 발생에 유의하게 기여하는지는 아직 분명하지 않다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">더구나 최근 대표적인
</span><span style="font-size: 11pt; font-family: TimesNewRoman;">inflammatory cytokine</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">인 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">IL-6</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이 오히려 인슐린감수성을 증가
시킨다는 연구결과들이 나오고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">33,34)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그러나 <b><span style="color: rgb(255, 0, 0);">근육 및 간</span><span style="color: rgb(255, 0, 0);">의 지방축적과 함께 이들 조직에서 염증반응의 </span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">signaling in-
termediate</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">인 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">IKK-</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">β</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, JNK1, suppressor of cytokine signaling 3
(SOCS3)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">의 활성이 증가된다는 연구결과</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt; color: rgb(255, 0, 0);">35-37)</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">로 미루어 볼 때
근육 및 간조직자체의 지방축적에 의해 유도된 </span><span style="color: rgb(255, 0, 0);">염증반응
이 이들 조직의 인슐린저항성 발생에 직접 영향을 미칠 수는
있으리라 생각</span></b>되고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서 <b><span style="color: rgb(9, 0, 255);">지방에 의한 인슐린저항성
발생의 초기단계에서 근육및 간조직</span><span style="color: rgb(9, 0, 255);">내 지방축적에 따른
염증반응의 역할을 배제할 수는 없지만 비만에 동반된 염증
반응은 인슐린저항성 발생에 선행하는 일차적 원인이기보다</span><span style="color: rgb(9, 0, 255);">는 조직의 지방축적에 동반되어 인슐린저항성을 더욱 악화</span><span style="color: rgb(9, 0, 255);">시킬 수 있는 추가요인으로 생각</span></b>된다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span></p><p><span style="font-size: 11pt; font-family: TimesNewRoman;"><br></span></p><p>
</p><div class="page" title="Page 5">
<div class="layoutArea">
<div class="column">
<p><span style="font-size: 11pt; font-family: YDIYGO130-KSCpc-EUC-H;"><b>제2형 당뇨병 및 대사증후군의 예방과 치료를 위한
인슐린저항성 치료전략
</b></span></p><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">많은 국내외 제약회사의 당뇨병 치료제의 개발과 향후 개발예정에도 불구하고 최근 대규모 역학연구에서 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">20</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">년 뒤 전
세계 당뇨병 환자의 유병률이 오히려 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">배로 증가할 것이라고 예측하고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">38)</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이는 <b><span style="color: rgb(255, 0, 0);">현재 사용 중이고</span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">개발예정인 당뇨병 치료제가 제</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">2</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">형 당뇨병 발생의 선행원인인 인슐린저항성보다 베타세포에서 인슐린 분비능을 타깃으로 하는 것이
주원인으로 생각</span></b>되고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 현재 대사증후군의 치료는
고혈압</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">이상지질혈증</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">당뇨병 등 각 질환별로 이루어지고
있으며 질병의 예방 및 근본적인 치료보다는 상태의 악화를
막는 유지요법에 치중하고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서 <b><span style="color: rgb(255, 0, 0);">막대한 의료비의 투</span><span style="color: rgb(255, 0, 0);">여에도 불구하고 질병의 유병률 및 질병에 의한 사망률이
감소하지 않고 오히려 급격히 증가하고 있는 실정</span></b>이다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서 <b><span style="color: rgb(9, 0, 255);">인슐린저항성 발생기전에 근거한 인슐린저항성 치료전략은 당뇨병 및대사증후군의 예방및 치료에 효율적인 방법</span></b>이 될 수 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.
</span></p><p><span style="font-size: 11pt; font-family: TimesNewRoman;"><br></span></p><span style="font-size: 11pt;">
</span><p><b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">비만 및 고지방식이에 의한 인슐린저항성 발생에서 인슐린 신호전달계를 억제하는 </span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">serine/threonine kinases </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">및 이들의
활성화에 직접 연관된 특이 지질대사체가 아직 완전히 규명</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">되지는 않았고</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H; color: rgb(255, 0, 0);">염증반응이 인슐린저항성 발생에 일부 관여하는 것으로 생각되지만</span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(255, 0, 0);">, </span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(255, 0, 0);">조직의 지방축적이 인슐린저항성
발생의 선행하는 직접적인 원인으로 생각됨으로 조직의 지방축적 감소가 인슐린저항성의 치료전략으로 연구</span></b>되고 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">조직의 지방축적을 감소시키는 방법중 간 및 근육조직
특이적 지방섭취의 억제는 다른 조직에 지방축적 및 인슐린
저항성을 초래하고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">식이조절은 조직의 지방섭취 및 합성을
억제하며</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">운동은 지방산화를 촉진시킬 수 있지만 이들 두
방법은 실제 지속하기가 어려운 현실적 단점이 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서
<b><span style="color: rgb(9, 0, 255);">지방합성</span></b></span><b><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(de novo synthesis/re-esterification)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><span style="color: rgb(9, 0, 255);">의 억제 및 지방산</span><span style="color: rgb(9, 0, 255);">화</span></span><span style="font-size: 11pt; font-family: TimesNewRoman; color: rgb(9, 0, 255);">(fat oxidation)</span></b><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">의 증가를 통해 조직의 지방축적을 감소시키</span><span style="color: rgb(9, 0, 255);">는 것이 효율적인 치료 타깃으로 생각</span></b>된다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그림 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">4).</span></p><p><span style="font-size: 11pt; font-family: TimesNewRoman;"><br></span></p></div><div class="column"><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">간은 포도당대사 및 지질대사의 핵심장기로 지방산 합성
경로가 활성화되어 있어 지방합성</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(de novo synthesis/re-est-
erification)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 억제가 지방축적을 호전시키는 효율적인 방법으로 생각된다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">유전자 기능 및치료타깃으로의 평가를 위하여 유전자조작 마우스</span><span style="font-size: 11pt; font-family: TimesNewRoman;">(Genetically engineered mouse, GEM)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">를 가지고 연구하는 것이 필수적이며 현재 보편화되어있는
기법이나 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">GEM</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">를 생산하는데 많은 비용과 시간이 소모되는
제한점이 있다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">그래서 간을 타깃으로 한 유전자의 생체기능
연구에서 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">GEM</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">을 이용하는 연구방법의 대안으로 생체 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">RNAi&nbsp;</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">기법이 최근 제시되었다</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">생체 주입된 </span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">RNAi</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">는 대부분 간으로 유입되고 근육</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">뇌</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">심장등 다른장기에 흡수되는 비율이
비교적 낮고 간의 타깃유전자를 효율적으로 억제할 수 있기
때문에 대사질환 연구에 좋은 연구방법으로써 이용될 수 있다</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">간에서 지방합성의 처음과 마지막 단계인 </span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">acetyl-CoA
carboxylase 1&amp;2 (ACC1&amp;2) </span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">및 </span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">diacylglycerol acyltransferase 2
(DGAT2)</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">를 각각 </span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">antisense oligonucleotide (ASO)</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">를 이용하여
</span><span style="font-size: 11pt; line-height: 1.6; font-family: 'TimesNewRoman,Italic';">in vivo</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">에서 이들 유전자의 </span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">mRNA</span><span style="font-size: 11pt; line-height: 1.6; font-family: YDIYMjO120-KSCpc-EUC-H;">를 선택적으로 억제하였을
때 간의 지방축적의 감소 및 인슐린저항성의 호전을 보이고
고지질혈증도 호전되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">39,40)</span><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;">.</span></p><p><span style="font-size: 11pt; line-height: 1.6; font-family: TimesNewRoman;"><br></span></p><span style="font-size: 11pt;">
</span><span style="font-size: 11pt;">
</span><div class="page" title="Page 6"><span style="font-size: 11pt;">
</span><div class="layoutArea"><span style="font-size: 11pt;">
</span><div class="column"><span style="font-size: 11pt;">
</span><span style="font-size: 11pt;">
</span><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">간과 달리 <b><span style="color: rgb(9, 0, 255);">근육은 체중의 </span></b></span><span style="font-size: 11pt; font-family: TimesNewRoman;"><b><span style="color: rgb(9, 0, 255);">30~40%</span></b></span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><b><span style="color: rgb(9, 0, 255);">를 차지하고 포도당 및
지방산 산화의 대표적인 장기</span></b>이다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서 근육의 지방축적
을 감소시키기 위해서는 지방산 산화를 촉진하는 전략이 가
장 효율적인 방법으로 생각되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">생체 에너지소모에서 정량적으로 가장 중요한 미토콘드리아로 지방산 이동 및 산화
를 촉진시키기 위해 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">ACC2</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 결핍</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">31) </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">및 미토콘드리아에서
에너지를 열로 발산하는 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">uncoupling protein 3 (UCP3)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 과발
현</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">41) </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">마우스에서 현저한 비만 예방효과와 인슐린저항성 호전이 보고되었고</span><span style="font-size: 11pt; font-family: TimesNewRoman;">, </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">또한 미토콘드리아 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">biogenesis</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">를 증가시켜
지방산 산화를 촉진하기 위한 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">calcineurin</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">42)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">과 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">PPAR</span><span style="font-size: 11pt; font-family: TimesNewRoman;">δ</span><span style="font-size: 11pt; font-family: TimesNewRoman; vertical-align: 5pt;">43)</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">의 근육 특이적 과발현 마우스 연구에서 </span><span style="font-size: 11pt; font-family: TimesNewRoman;">type I muscle fiber </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">및 미
토콘드리아의 현저한 증가와 함께 고지방식이에 의한 비만
및 인슐린저항성이 예방되었다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">. </span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">따라서 <b><span style="color: rgb(255, 0, 0);">근육과 간의 지방축적을 감소시켜 인슐린저항성을 예방 및 호전시키는 것은 당</span><span style="color: rgb(255, 0, 0);">뇨병 및 대사증후군의 효과적인 예방 및 치료전략으로 생각</span></b>된다</span><span style="font-size: 11pt; font-family: TimesNewRoman;">.&nbsp;</span></p>
</div>
</div>
</div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span><span style="font-size: 11pt;">
</span><p><span style="font-family: YDIYMjO120-KSCpc-EUC-H; font-size: 11pt; line-height: 1.6;">&nbsp;</span><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;">&nbsp;</span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><p><span style="font-size: 11pt; font-family: YDIYMjO120-KSCpc-EUC-H;"><br></span></p><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
</span></div><span style="font-size: 11pt;">
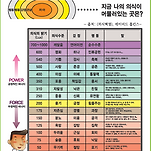
</span></div><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><span style="font-size: 11pt; line-height: 23px;">참고) 인슐린 저항성의 지표중 하나는 여드름</span></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p><p><br></p><p style="text-align: center;"><img src="https://t1.daumcdn.net/cfile/cafe/9960B5425D34EBEA20" class="txc-image" actualwidth="710" hspace="1" vspace="1" border="0" width="710" exif="{}" data-filename="스크린샷 2019-07-22 오전 7.39.42.png" style="clear:none;float:none;" id="A_9960B5425D34EBEA20651A"/></p><p></p><p style="text-align: center;"><img src="https://t1.daumcdn.net/cfile/cafe/9960E3425D34EBEA20" class="txc-image" actualwidth="862" hspace="1" vspace="1" border="0" width="862" exif="{}" data-filename="스크린샷 2019-07-22 오전 7.41.29.png" style="clear:none;float:none;" id="A_9960E3425D34EBEA201936"/></p><p><span style="font-size: 15px; line-height: 23px;"><br></span></p>
<!-- -->