|
[암과 싸우는 사람들] 네이버밴드로 초대합니다.
유방암 표적치료제를 아시나요?
일반적으로 항암제는 빨리 증식하는 암세포의 성장 속도를 이용하여 만들어지기 때문에 정상적인 세포 중 빨리 자라는 모발세포, 생식계 세포 등도 항암제의 영향을 받는다. 즉, 세포에 대한 무차별적 공격으로 정상세포와 암세포 모두 영향을 받게 됩니다. 많은 악성 종양 중에서 유방암은 전세계 여성에게 가장 흔한 암이죠. 매년 140만 명의 새로운 환자가 전 세계적으로 진단되고, 45만 명 이상이 매년 이 병으로 죽어간다고 하네요. 여성 네 명당 한 명꼴로 영향을 받아서 소위 "HER2-양성" 유방암으로 발전한답니다. 이 종양은 화학 요법에 매우 저조한 반응을 보이는 매우 공격적인 형태랍니다. 그런데 유방암과 관련된 암세포의 성장, 분화 및 생존에 있어 신호 전달 경로의 활성화가 중요한 역할을 합니다. 신호전달경로를 활성화 시키는 중요한 매개 효소에 티로신 키나제(tyrosine kinase)가 있습니다. 인간 상피세포 성장 인자 수용체(EGFR, Human Epidermal Growth Factor Receptor)는 네 종류(HER1, HER2, HER3, HER4)가 있으며, 여기에 '리간드'라는 물질이 결합하게 되면 티로신 키나제(tyrosine kinase)의 활성 과정을 거친 후, 세포 내로 세포 성장 신호를 전달하여 이에 따라 암세포의 생존이나 증식, 전이를 일으키게 됩니다. 그러므로 티로신 키나제(tyrosine kinase)의 활성을 억제하는 표적치료제들이 개발되었습니다.
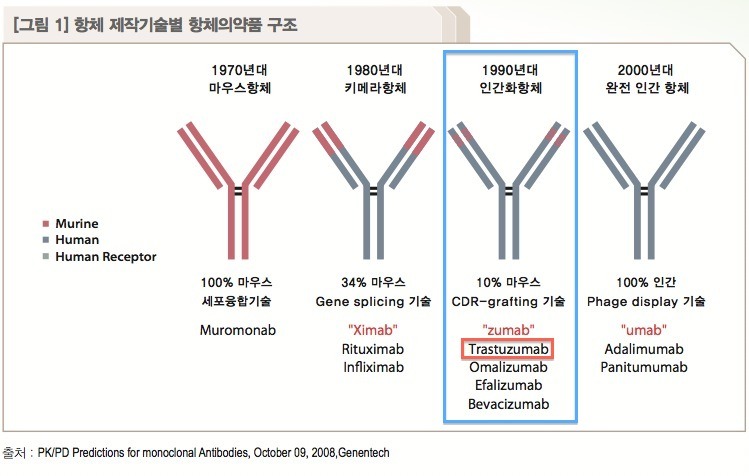
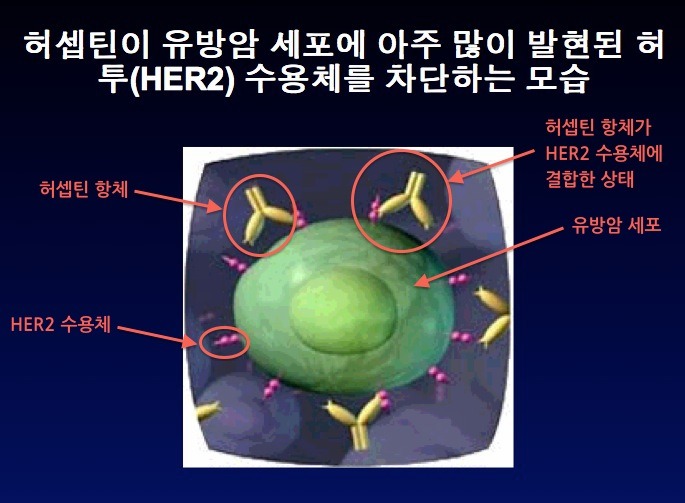
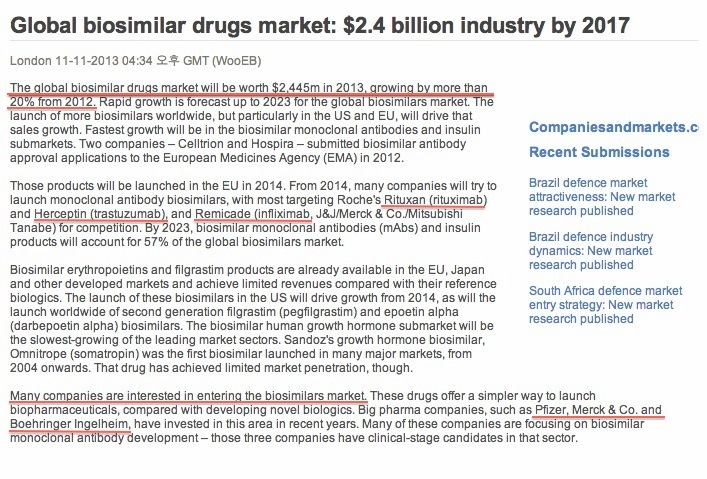
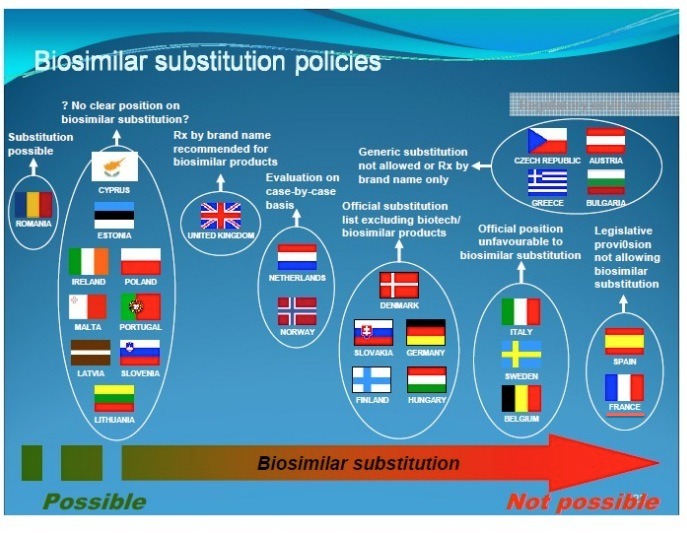
위의 그림에 나타난 바와 같이 HER2neu(이하 HER2) 유전자는 인체의 17번 염색체에 위치하는 암유전자의 일종인데, 이것에 의해 발현되는 HER2 단백질 (또는 ErbB2)은 유방암 환자에게서 과잉 발현되는 것으로 조사되었죠. 'HER2라고 불리는 수용체'(인간표피 성장인자 수용체-2)의 과발현은 티로신 키나제의 활성을 증가시켜 유방암의 발생이나 진행에 중요한 역할을 합니다. 따라서 유방암을 치료하기 위한 표적치료 항암제는 기존의 항암제와 달리 발암과정의 특정 표적인자만을 선택적으로 억제하여 정상세포를 보호하고 암세포만을 공격합니다. 다시 말해서 정상세포에서는 발현이 안 되거나 미미하지만, 암세포에서는 발현이 증가되는 분자들을 발견해내고 그 작용을 차단함으로써 비교적 선택적으로 암세포만 공격하는 치료제입니다. 이에 따라 부작용을 최소화하면서도 치료 효과는 향상시키는 장점이 있습니다. 다국적 제약사인 로슈가 개발한 ‘허셉틴’(성분명 트라스투주맙)은 유방암의 대표적 표적치료제입니다. 특정 표적인자만을 선택적으로 억제하여 정상세포를 보호하고 암세포만 공격하여 항암제의 부작용을 최소화했습니다. 특히 허셉틴은 유방암 세포에서 HER2가 정상세포보다 많이 발현된다는 점에 착안되어 개발되었습니다. HER2는 세포의 성장에 관여하는 단백질로 암세포가 빠르게 성장하도록 신호를 보냅니다. 따라서 HER2 과발현 유방암의 경우에는 재발이 많으며 예후가 좋지 않은 것이 특징입니다. 허셉틴은 문헌 [Hudziak, R.M., et al., Mol. Cell. Biol 9, 1165-1172 (1989)]에 기술된 뮤린 항-HER2 항체 4D5의 재조합 인간화 변이체이며, 허셉틴은 HER2에 대한 단일클론 항체입니다. 그런데.... 위의 자료처럼 허셉틴(트라스투주맙)은 ‘인간화항체’라고 하는데, 90%의 인간 항체와 10%의 뮤린 항체가 결합된 상태입니다. 허셉틴은 뮤린 항-HER2 항체 4D5와 동일한 HER2의 에피토프, 즉 암세포 표면의 HER2에 특이적으로 결합하여 신호전달을 차단하여 암세포 성장을 억제합니다. 또한 허셉틴은 체내 면역체계 활성화를 도움으로써 HER2 과발현 유방암 환자의 생존 기간을 30개월 이상 연장시킵니다. 특히, HER2가 과발현된 유방암 환자에게 수술 후 기존 항암제와 더불어 1년간 허셉틴을 투여할 경우 암 재발위험을 50%, 사망위험도 30% 수준까지 감소시킵니다. 그래서 허셉틴 주사를 맞으면 유방암 환자의 몸 속에 허셉틴이 돌아다니면서 HER2 수용체에 결합하여 티로신 키나제의 활성을 억제함으로써, 결과적으로는 HER2를 발현하는 유방암 세포를 골라서 죽이게 됩니다. 따라서 HER2 과발현 전이성 유방암 환자들의 생존 기간을 연장하는 역할에 그치는 것이 아니라, HER2 과발현 조기 유방암 환자들의 완치율을 높인다는 점에서 획기적인 치료제로 평가받고 있습니다. 또한 최근에는 허셉틴이 유방암뿐만 아니라, HER2 과발현 진행성 위암에도 효과가 있는 것으로 확인됐습니다. 미국 올랜도에서 진행된 미국임상암학회에서 발표된 임상연구에 따르면 기존 표준 항암요법에 허셉틴을 추가함으로써 HER2 과발현 진행성 위암 환자의 생존 기간이 평균 13.8개월로 3개월이 연장되고 사망률도 약 26%까지 낮춰주는 것으로 밝혀졌습니다. 특히 HER2 과발현의 정도가 높은 환자에게는 생존 기간이 평균 16개월로 더 우수한 효과를 나타냈습니다. 허셉틴은 1998년 미국 FDA에 HER2 과발현 전이성 유방암 환자의 생존 기간을 연장하는 치료제로 승인됐고, 국내에는 2003년 출시됐습니다. 2006년에는 HER2 과발현 조기 유방암 치료제로 적응증이 확대됐습니다. HER2 과발현 유방암은 전체 유방암의 20~30%를 차지합니다. 지금까지 살펴본 바와 같이 허셉틴의 효용에 대해서는 거의 입증이 되었지만, 그 비용이 매우 비싸서 현실적으로 이용하기에는 많은 부담이 있는 것이 사실이죠. 그런데 드디어 한국의 셀트리온이 유방암 표적항암제인 허셉틴 바이오시밀러인 허쥬마를 개발하여 국내 시판승인을 받았습니다. 식품의약품안전처는 유방암 표적항암제인 허셉틴의 바이오시밀러를 최근 15일에 허가했습니다. 해당 적응증은 '전이성 유방암과 조기 유방암, 전이성 위암'입니다. 관련 절차를 거쳐 이르면 올해 상반기부터 쓸 수 있습니다. 셀트리온 관계자는 "국내 바이오제약산업의 발전에 기여해 우리나라가 세계적 바이오강국으로 성장할 수 있는 기반이 될 것"이라고 말했습니다. 유방암으로 고통받은 많은 여성들을 위해서라도 허셉틴 바이오시밀러인 '허쥬마'가 국내 시판 승인을 받음으로써, 좀 더 저렴한 가격에 치료받게 되었습니다. 물론 경제적인 여유가 많다면 오리지널 허셉틴 투여에 대해 부담이 적겠지만, 현실적으로 대다수의 유방암 환자들이 그렇게 여유가 많지 않을 겁니다. 허쥬마로 말미암아 말기 유방암 환자의 생존율을 증가시키는데 기여한다면, 그것이야말로 허쥬마를 개발한 셀트리온의 이념이 아니고 무엇이겠나요? 식약처의 시판 승인으로 이제는 유럽식약청(EMA)의 승인을 조속히 받아야 하겠죠. 램시마처럼 허쥬마도 EMA 승인으로 연결되어 전세계 유방암 환자들에게 희망이 되기를 바라네요. 위의 자료 제목은 "글로벌 바이오시밀러 의약품 시장: 2017년까지 24억 달러 산업"이라는데, 내용의 첫줄은 "글로벌 바이오시밀러 의약품 시장은 2013년에 24억 4천 5백만 달러 가치가 있을 것이며, 2012년에 비해 20% 이상 성장할 것이다"라고 하네요. 그렇다면 제목의 2017년이 오타인 듯 보이네요. 어쨌든 글로벌 항체 바이오시밀러 시장이 추후 엄청나게 성장한다는 겁니다. 바이오시밀러 중에서도 단일클론 항체, 특히 리툭산 / 허셉틴 / 레미케이드 바이오시밀러에 대해 집중적인 관심을 표하고 있네요. 이 3가지 항체 바이오시밀러 중에서 레미케이드의 경우에는 셀트리온이 최초로 EMA 승인을 획득했고, 허셉틴의 경우에는 승인을 기다리는 중인데 허쥬마 역시 최초로 EMA 승인을 받을 것으로 봅니다.그렇다면 2개 제품의 바이오시밀러로 세계 석권을 기다리는 중이라는 것, 요게 가장 중요한 포인트가 되겠네요. 그런데 많은 제약사들이 바이오시밀러 시장에 관심을 갖고 있는데, 빅 파마 제약사로는 화이자, 머크, 베링거 인겔하임을 꼽았네요. 이 중에서 베링거 인겔하임은 자체 생산공장을 가지고 있지만, 화이자나 머크는 바이오시밀러를 양산할 공장이 형편없는 실정이 아니던가요? 그렇다면 셀트리온의 인수 대상자로 유력하지 않을까 싶군요. 셀트리온을 인수한다면 화이자나 머크, 아스트라제네카가 유력하겠고, 개인적으로는 화이자나 머크가 인수해주기를 바라구요, 서정진 회장 역시 매각 방침을 고수하고 있다고 봅니다. 아직까지 매각방침에 변화가 있다는 공식적인 발표가 없으니까요~!!!! 위의 자료에서 보시는 것처럼, 처방전과 상관없이 약사에 의한 성분명 처방을 하는 '대체투약'(substitution)를 금지하는 국가는 스페인과 프랑스입니다. 대체투약를 금지한다고 교체투약(switching; 의사 처방전에 의한 바이오시밀러 투약)을 인정하지 않는 것은 아닙니다. 대체투약에 반대 의견을 가진 국가는 이탈리아 스웨덴 벨기에이며, 대체투약을 허용하지 않거나 브랜드 이름에 의한 처방을 요구하는 국가는 오스트리아와 불가리아를 포함한 4개국이고, 대체투약을 할 수 있는 의약품에 대한 공식 목록을 가진 국가는 덴마크 슬로바키아를 포함한 5개국이며, 제품별로 평가하는 국가는 네덜란드와 노르웨이이며, 브랜드 이름으로 처방하는 국가는 영국이며, 대체투약을 결정하지 않는 국가는 9개국이며, 대체투약을 허용하는 국가는 루마니아입니다. 원래 프랑스는 스페인과 함께 바이오시밀러에 대해 대체투약 불가를 외치던 가장 강력한 국가였는데, 최근 프랑스가 대체투약을 허용하는 법안을 통과시켰답니다. 그렇다면 스페인을 포함하여 대체투약에 부정적인 국가가 이탈리아, 스웨덴, 벨기에 순인데 이들의 추이도 궁금하네요. 항체 치료제가 워낙 고가이다 보니까, 서유럽의 경우 항체 바이오시밀러가 시판되는 내년 초를 대비하여 재정적자를 감소시킬 목적으로 프랑스 같은 국가조차 항체 바이오시밀러에 유리하도록 법률을 통과시킨 것 같더군요.
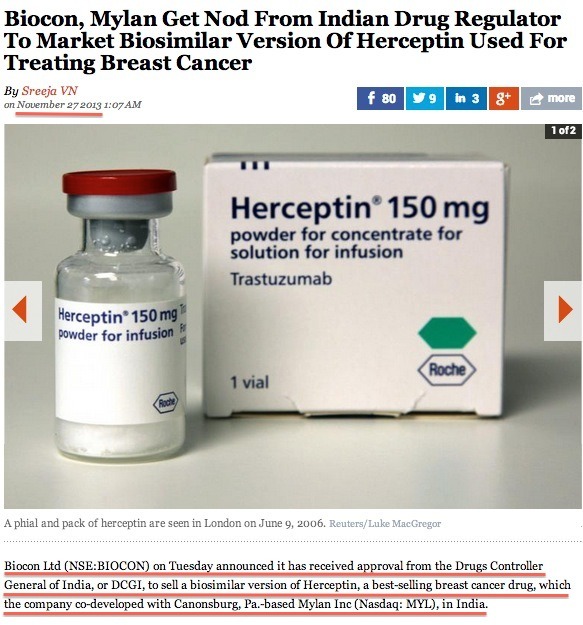
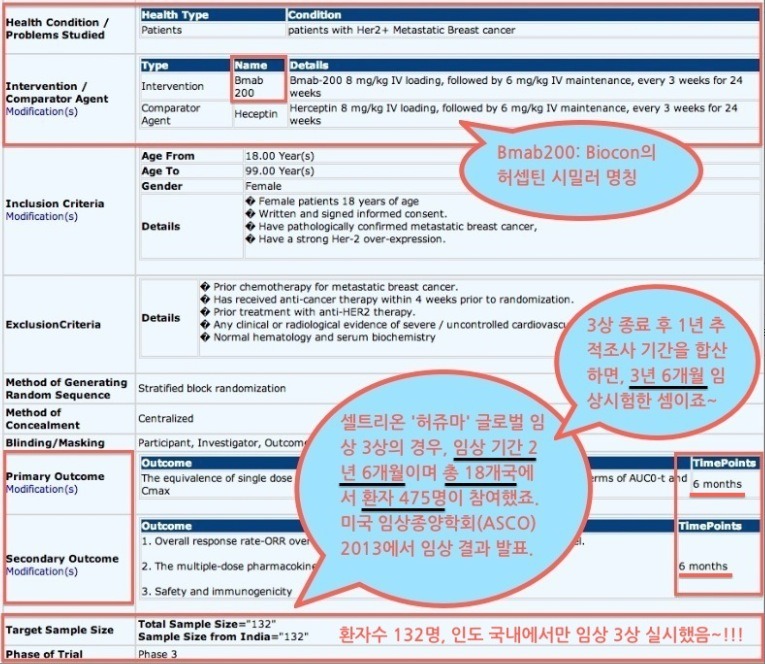
프랑스가 이 정도라면 다른 나라들은 더 말할 필요도 없을 것 같네요. 전세계적으로 셀트리온의 항체 바이오시밀러 램시마(2012년 레미케이드 전세계 매출 74억 6,800만 달러)와 허쥬마(2012년 허셉틴 전세계 매출 64억 달러)에 유리한 국면이 바야흐로 조성되고 있네요. 후발주자들의 임상시험 속도를 감안하면, 최소한 3년 정도는 항체 치료제 시장에서 독점적인 위치를 구가할 것으로 보이네요. 작년 11월 27일 보도에 따르면, 인도 제약사 Biocon과 다국적 제약사 Mylan이 공동으로 개발한 허셉틴 바이오시밀러가 인도 당국으로부터 시판 승인받았다고 했죠. 이 내용만 보면 최초의 허셉틴 바이오시밀러는 Biocon과 Mylan이 차지한 것으로 오해할 수 있는데요, 인도에서 시판 승인받았다고 해서 국제적인 권위를 가진 EMA(유럽의약청) 혹은 미국 FDA에서 인정한 것은 아닙니다. 그걸 어떻게 알 수 있느냐구요? 위의 자료는 Biocon과 Mylan이 허셉틴 바이오시밀러 임상 3상에 대한 데이터인데, 셀트리온의 허셉틴 바이오시밀러인 허쥬마가 EMA의 승인하에 임상 3상을 실시한 데이터와 비교한 것입니다. 차이가 나도 아주 많이 나죠? 그래서 인도 이외의 지역에서는 쉽게 통용되기 어렵다는 것이죠. 다른 의약품도 아닌 함암제인데, 신뢰성이 떨어지는 제품을 누가 사용하려고 할까요? 인도에서 Biocon & Mylan의 허셉틴 바이오시밀러 시판가격이 허셉틴의 70% 정도로 알고 있는데, 이 가격은 허쥬마와 거의 비슷할 것 같네요. 어차피 인도 내에서 허쥬마와 가격 경쟁이 안 된다면, 품질 경쟁을 하게 되겠죠. 마지막으로 강조하고 싶은 것은.... '램시마'(류마티스 관절염 치료제인 레미케이드 바이오시밀러) 3상 결과와 '허쥬마'(항암제 허셉틴 바이오시밀러) 3상 결과가 거의 동일했다는 점과 한국식약청의 허가 심사 기준이 EMA에 못지 않게 엄격하다는 사실입니다~!!!!
|
출처: 현대의학,자연의학 그리고 의용공학의 세계 원문보기 글쓴이: 라이프