|
국내 연구진이 암세포를 만나면 팽창하여 내부에 들어있는 항암제를 쏟아내는 신소재를 개발해냈다. 암세포에 특이적인 산성환경에 반응하여 모양이 달라지는 신소재로 만든 나노캡슐에 항암제를 넣을 경우 암세포에만 약물을 전달할 수 있어 정상세포에 대한 부작용을 줄일 수 있는 원천기술이 될 것으로 기대된다.
부산대학교 고분자공학과 김일 교수와 Renjith P. Johnson 박사과정 학생, 부산대학교 의학전문대학원의 강대환 교수가 주도한 이번 연구는 교육부(장관 서남수)와 한국연구재단(이사장 이승종)이 추진하는 세계적 연구중심대학(WCU) 육성사업의 지원으로 수행되었고, 연구 결과는 고분자분야 권위지 Biomacromolecules지 4월 10일자 온라인판에 발표되었다. 한편 연구진의 선행연구는 지난해 재료분야 권위지 Advanced Functional Materials에 게재된 바 있다.
(논문명 : Dual Stimuli-Responsive poly(N-isopropylacrylamide)-b-poly(L-histidine) Chimeric Materials for the Controlled Delivery of Doxorubicin into Liver Carcinoma)
정상세포에 비해 암세포가 산성을 띠는 점에 착안해 암세포에만 작용할 수 있도록 체온과 비슷한 온도에서 산성환경에 감응하는 신물질에 대한 연구가 활발하다. 하지만 기존 합성 고분자의 조합으로 만든 물질은 분해가 잘 되지 않아 생체적합성이 떨어지고 나노크기 캡슐로 제작하는데 한계가 있었다.
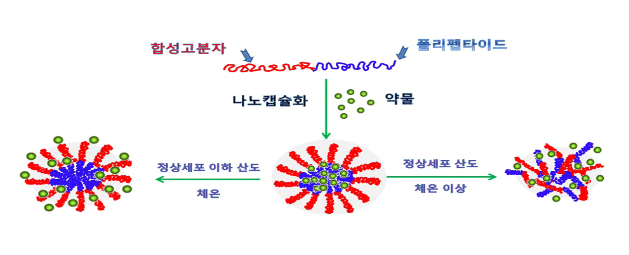
부산대학교 연구팀은 산도가 낮아지면 팽창하는 폴리펩타이드와 체온과 비슷한 온도에 반응하여 팽창하는 합성고분자를 결합시켜 암세포를 만났을 때 팽창하는 신소재를 개발해냈다.
항암제를 이 나노캡슐에 담아 주사하면 산성인 암세포에서 팽창하면서 마치 밸브가 열리듯 캡슐에 담긴 항암제가 방출되어 암세포에만 전달될 수 있다. 약물이 정상세포에 작용함으로써 야기되는 부작용을 줄일 수 있게 된다.
연구팀은 나아가 항암제 독소루비신을 탑재한 감응형 캡슐을 간담도암, 결장암, 간암 세포 등에 시험하여 암세포의 사멸효과를 확인했다. 암세포에만 캡슐을 선택적으로 전달할 수 있는 핵심기술은 기능을 다한 후 분해되는 폴리펩타이드의 장점에 물과 유기용매에 잘 녹아 쉽게 성형할 수 있는 합성고분자의 장점을 결합시킨 후 온도와 산도 같은 외부환경에 따라 구조가 변하는 성질까지 탑재시킨 데 따른 것이다.
한편 나노캡슐로 만드는 방법도 간단하다. 세포를 둘러싼 이중막처럼 물과 친한 합성고분자와 물과 친하지 않은 폴리펩타이드의 자기조립 현상을 이용해 100 나노미터 크기 이하의 나노캡슐을 만들 수 있다.
특히 물과 기름에 모두 잘 섞이는 재료로 되어 있어 친수성과 소수성 약물을 한 번의 공정으로 캡슐에 담을 수 있다.
김 교수와 강 교수는 “간단한 중합공정을 통해 얻은 첨단소재를 이용하여 간단한 조작을 통해 약물을 담을 수 있는 고분자 나노캡슐을 만든 것 ”이라며,
“온도와 산도에 감응하기 때문에 향후 다양한 방출패턴을 보유한 약물전달 시스템 구축에 활용될 수 있어 한 번의 복용으로 많은 약물을 투여한 효과를 얻음으로써 환자의 고통을 덜어 주는 것은 물론 심각한 부작용을 줄일 수 있을 것으로 기대된다”고 밝혔다.
연 구 결 과 개 요
1. 연구배경
암 치료를 위한 효과적인 약물전달시스템의 개발은 환자의 고통을 덜고, 효과는 극대화하되 부작용을 줄여야한다는 점에서 쉬운 과제가 아니다. 특히 약물이 체온에 감응하고, 암세포가 정상세포에 비하여 낮은 산도를 가진 점을 감안하여 산도에 감응하는 고분자재료의 개발은 매우 중요하다.
다양한 종류의 감응형 합성 고분자가 발표되었으나, 생체적합성이 떨어지고, 온도에만 감응하거나, 산도에만 감응하는 단점을 보였다. 또한 애써 설계한 고분자를 약물전달에 이용하기 위해서는 100 나노미터 이하 크기의 캡슐로 제조하여야 하는데 종래의 재료로는 캡슐의 제조가 어렵고, 수율이 낮음은 물론 지나치게 크거나 약한 특징을 보였다. 또한 수용성이 낮아 이체에 사용할 수 없는 경우도 있었다.
펩타이드는 종래의 합성고분자에 비하여 생체적합성이 우수하고 매우 안정하고 강하며, 기능을 다한 후에는 분해되는 고차 구조로 자기조립되는 장점을 갖고 있다. 그러나 물과 유기용매에 녹지 않아 원하는 구조를 만드는 것이 불가능하였다. 반면 합성고분자는 생체적합성은 떨어지나 유기용매는 물론 물에 잘 녹는 특징을 보이기 때문에 원하는 모양으로 쉽게 성형할 수 있다.
따라서 펩타이드와 합성고분자의 장점을 잘 이용하면 용해도도 우수하고, 원하는 구조로 자기조립 되는 신소재를 제조할 수 있다. 여기에 온도와 산도 등 외부환경에 감응하는 성질까지 탑재할 수 있다면 꿈의 약물전달 재료를 구축할 수 있다. 몸속에 존재하는 세포 중에서 정상세포에는 작용하지 않고 암 세포를 만났을 때만 작용하는 나노밸브형 재료를 구축할 수 있어, 치료 효과는 극대화하고, 부작용은 최소화할 수 있기 때문이다.
2. 연구결과
본 연구에서는 수용성을 보이며 온도에 민감하여 체온에 이르렀을 때 팽창하는 폴리아크릴 아마이드계 합성고분자에 폴리펩타이드의 일종이며, 산도가 낮아지면 팽창하는 성질을 보이는 폴리히스티딘을 결합시켜 새로운 하이브리드재료를 제조하였다. 이 재료는 이종의 물질로 구성되었지만 생체적합성을 보이고, 소수성과 친수성을 동시에 보이는 분자키메라 소재이다. 종래의 기술은 이와 같은 성질의 발현을 위해 이종의 합성고분자를 조합하여 제조하여 생체적합성이 떨어지고 약한 물성을 보여 인체에 사용하기에 적합하지 않았다.
제조된 합성고분자-폴리펩타이드 조합 소재는 간단한 조작에 높은 수율로 100나노미터 이하의 나노캡슐을 형성하였고, 소수성 혹은 친수성 약물을 캡슐 내에 쉽게 도입할 수 있었다. 예를 들어 항암제로 흔히 사용되는 독소루비신을 캡슐 내에 도입할 수 있었으며, 분말상태로 만들어도 안정한 구형 캡슐형태를 유지하였다. 합성고분자만으로 이루어진 재료에 비해 크기도 작을 뿐만 아니라 물성이 우수하였다.
독소루비신을 탑재한 나노캡슐을 체온에서 간담도암, 간암, 결장암 등의 세포와 이틀간 배양한 결과 60%의 암세포가 사멸됨을 알 수 있었다. 반면에 같은 조건으로 정상세포와 배양하면 10%정도의 세포만이 영향을 받음을 알아냈다. 이는 개발된 재료가 온도가 체온에 이르고, 암세포와 같이 산성이 낮은 조건에서 독소루비신을 선택적으로 배출하는 나노밸브 역할을 하기 때문이다.
따라서 개발된 나노캡슐은 암 세포만을 선택적으로 사멸시키지만 정상세포에는 영향을 주지 않는 기능을 발휘한다 할 수 있으며, 치료 효과는 극대화하고 부작용은 최소화하는 시스템이라 할 수 있다.
3. 연구결론
본 연구실은 인체의 구성성분이며 산도 변화에 민감한 폴리펩티드를 온도에 민감한 합성고분자와 접목시킨 신개념 분자키메라 물질을 제조하였다. 이 재료는 1) 생체적합성이 뛰어나고 2) 물성이 우수하며, 3) 쉽게 자기조립되어 100나노미터 이하의 나노캡슐을 형성하며 4) 다양한 소수성 및 친수성 약물을 도입할 수 있으며, 5) 온도와 산도 변화에 동시에 감응함으로써 암세포에 선택적으로 작용할 수 있는 특징을 보였다. 이와 같은 특징을 이용하면 약물전달, 나노센서, 향장산업, 정밀화학제품 등 다양한 분야의 기술 개발에 활용될 수 있을 것으로 생각된다.
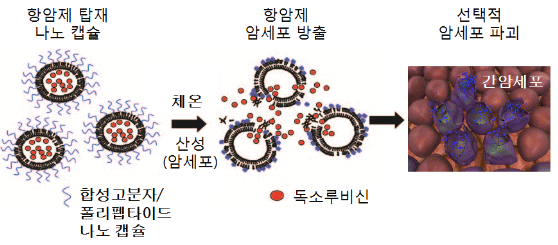
그림 1. 암세포를 선택적으로 파괴하는 항암제 탑재 나노캡슐 모식도
합성고분자와 폴리펩타이드를 접목시켜 100나노미터 이하의 나노캡슐을 제조함과 동시에 독소루비신과 같은 약물을 이 캡슐에 도입한다. 이 나노캡슐은 온도와 산도에 감응하기 때문에 온도가 체온에 이르고 정상세포에 비하여 산성인 암세포를 만났을 때 선택적으로 팽창하여 암세포에 독소루비신을 전달하여 암세포를 선택적으로 파괴한다.
Journal reference
Dual Stimuli-Responsive poly(N-isopropylacrylamide)-b-poly(L-histidine) Chimeric Materials for the Controlled Delivery of Doxorubicin into Liver Carcinoma
Renjith P. Johnson, Young-Il Jeong, Johnson V. John, Chung-Wook Chung, Dae Hwan Kang, Manickam Selvaraj, Hongsuk Suh, and Il Kim
Biomacromolecules Just Accepted Manuscript
Memo:
암세포와 염증 주변에는 인체의 정상 pH농도인 7.3-7.5 레벨보다 낮은 수치를 형성하여 면역세포가 공격할 수 없도록 보호막을 형성하고 있다. 이 것을 해결하는 방법은 2가지이다. 첫째는 특별한 자기장을 공명 공진시켜 정상 pH수치가 되도록 유도하여 보호막을 해제시켜 면역 세포가 공격을 할 수 있도록 길을 터주는 방식이며 두번째는 상기와 같은 방법으로 정상pH 수치보다 낮은 것을 인지하면 캡슐에서 약물을 터트려져 항암 약물로 공격을 하는 방법이다.
그리고, 상기 제품이 상용화 된다면 항암 약물로 인한 각종 부작용을 줄이고 치료 효율을 높일 수 있는 획기적인 전기가 마련되리라 생각한다, 그리고 전 세계적으로 다양한 분야에서 암치료에 관하여 연구를 하고 있으며 향후 더욱더 효과적인 암 치료법이 개발되어 암과 싸우는 많은 환자에게 새로운 희망이 되었으면 하는 바램이다.
그리고 암 세포는 정상세포와 달리 특별한 자기장을 띄고 있다는 것에 착안하여 포라디움 물질을 이용하여 암세포를 공격하는 방법도 있지만 아직 국내에는 도입되고 있지 않고 있다. 이러한 것은 정부 차원에서 도입을 하여 기존의 치료와 더불어 병행하여 치료할 수 있었으면 한다, 아직 암에 관한 한국의 의료분야는 너무 경직이 되어 선진 외국의 새로운 치료법의 혜택을 보지못하고 있어 개인적으로 매우 안타까운 일 이다,
또한 이러한 방법외도 과학적으로 검증된 치료법이나 보조적 요법이 있다면 의료계에서는 적극적으로 수용하여 검토하고 암환들에게 보급이 되었으면 하는 바램이다. 아직도 기득권을 내세워 현실에만 안주를 하는 암 치료 현실은 개선이 되어야 한다/의공학 전문가 김동우 010.7216.6789
|